Purine
La purine Écouter est une molécule azotée hétérocyclique constituée d'un cycle pyrimidine fusionné à un cycle imidazole. C'est l'hétérocycle azoté le plus répandu dans la nature[2]. Parmi les neuf tautomères possibles du noyau purine, les formes CH (C2H, C4H, C5H, C6H et C8H), ainsi que les formes N1H et N3H peuvent être négligées car très peu probables (rupture d'aromaticité), seules les formes N7H et surtout N9H (99 %) existent en solution neutre[3]. Le noyau purine nu n'existe pas dans la nature. On trouve en revanche de nombreux dérivés aminés, hydroxylés ou méthylés, souvent sous forme de nucléosides[2], qui sont inclus dans le terme général purines. Deux des bases nucléiques présentes dans tous les acides nucléiques sont des purines : l'adénine et la guanine. Dans l'ADN, ces bases forment des liaisons hydrogène avec les pyrimidines complémentaires, la thymine et la cytosine.
| Purine | |
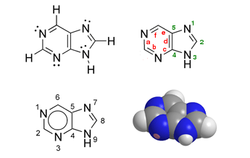
| |
| Structure et représentation de la 9H-purine ou (3H-imidazo)[4,5-d]pyrimidine | |
| Identification | |
|---|---|
| Nom UICPA | Purine |
| Synonymes |
imidazo[4,5-d]pyrimidine |
| No CAS | (9H-purine) |
| No ECHA | 100.004.020 |
| No CE | 204-421-2 (1H-purine) |
| PubChem | 1044 (7H-purine) |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C5H4N4 [Isomères] |
| Masse molaire[1] | 120,112 1 ± 0,005 1 g/mol C 50 %, H 3,36 %, N 46,65 %, |
| Propriétés physiques | |
| T° fusion | 214 °C |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
La xanthine, l'hypoxanthine et l'acide urique sont d'autres purines résultant de la dégradation des bases puriques (adénine et guanine) ; la caféine, la théobromine et la théophylline sont classées parmi les alcaloïdes.
Les purines, en plus d'être des composants de l'ADN et de l'ARN, se retrouvent dans des biomolécules importantes, telles que l'ATP, GTP, AMP cyclique, NADP, SAM ou coenzyme A. La molécule d'ATP est particulièrement importante car elle est la source d'énergie pour les cellules vivantes et le cofacteur de nombreuses enzymes comme les protéine kinases. Le noyau purine constitue une plate-forme privilégiée en chimie médicinale, à partir de laquelle de très nombreux dérivés et analogues ont été élaborés, possédant diverses propriétés pharmacologiques remarquables et conduisant même, dans certains cas, à des médicaments[4].
- Représentation de quelques purines
-
La guanine (G), une des bases des acides nucléiques, est une purine. Elle est la base complémentaire d'une pyrimidine : la cytosine (C) (dans l'ADN et l'ARN).
-
La xanthine
-
L'acide urique
Histoire
modifierLe chimiste allemand Hermann Emil Fischer, après lui avoir donné son nom en 1884, a synthétisé la purine en 1898 à partir de l'acide urique, et montré qu'elle formait une famille chimique.
Sources alimentaires
modifierPurines (mg pour 100 g) :
- d'origine animale
- ris de veau[5] : 990
- viande rouge (musculaire) : 80 à 120
- anchois[5] : 465
- d'origine végétale
- légumineuses[5] : 50
- cacao : 1 200
- thé (feuilles séchées) : 2 200
- levure de bière sèche micro-éclatée : 5 000
- bière, même sans alcool, riches en purines (susceptible de provoquer ou aggraver les crises de goutte, y compris les bières sans alcool, qui contiennent de la guanosine)[6],[7].
- Fruits
- Produits laitiers:
Métabolisme
modifierLes voies métaboliques de nombreux organismes permettent de synthétiser et de cataboliser les purines. Chez l'Homme, le catabolisme se fait uniquement par élimination dans les urines de l'acide urique.
Une étude récente (2017) montre chez la souris de laboratoire qu'un champignon faisant partie du microbiote intestinal module le métabolisme de la purine, pouvant exacerber la colite chez cet animal[9].
Pathologie
modifier- La goutte : pathologie qui résulte d'un trouble de la dégradation des purines qui entraîne une accumulation d'acide urique dans le plasma[9]. Cet acide se couple au sodium, ce qui forme des cristaux d'urate de sodium qui se stockent dans le liquide synovial des articulations créant de fortes douleurs. Certains anticancéreux induisent la présence d'acide urique dans le sang.
- La maladie de Crohn (maladie intestinale inflammatoire) a pu être reliée à une augmentation anormale des anticorps dirigés contre la levure Saccharomyces cerevisiae qui fait partie du microbiote (au sein du microbiote commensal de l'homme) et il est démontré chez la souris qu'une colonisation accrue de l'intestin par cette levure exacerbe la colite en augmentant le métabolisme des purines ce qui se traduit par une dégradation de l'épithélium intestinal ce qui accroît la perméabilité de barrière intestinale ; une corrélation de ce type a aussi été trouvée dans le sérum chez l'humain[9].
On a montré en 2017 chez la souris que l'allopurinol (un médicament bloquant la voie purine) inverse ces dommages.
Le transcriptome du tissu du côlon provenant de souris sans germes inoculées avec S. cerevisiae ou Rhodotorula aurantiaca (autre microchampignon de l'intestin) a été étudié, montrant que la barrière intestinale et le métabolisme de l'hôte sont négativement affectés par ces organismes[9].
Un screening métabolomique fécal d'animaux de laboratoire exempts de germes a confirmé que ces organismes en dopant le métabolisme de la purine de l'hôte y augmentaient aussi l'acide urique, qui aggrave la maladie de Crohn. Il augmente la perméabilité intestinale[9].
Notes et références
modifier- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- H. Rosemeyer, The Chemodiversity of Purine as a Constituent of Natural Products, Chemistry & Biodiversity, 2004, 1, 361-401.
- Raczyńska et Kamińska, J. Phys. Org. Chem., 2010, 23 828–835
- M. Legraverend et D. S. Grierson Bioorg. Med. Chem., 2006, 14, 3987-4006
- Tables de composition des aliments, éditions Jacques Lanore
- Hang Korng Ea, « De l’hyperuricémie à la goutte : physiopathologie », Revue du Rhumatisme, actualités sur la goutte, vol. 78, , S103–S108 (ISSN 1169-8330, DOI 10.1016/S1169-8330(11)70021-7, lire en ligne, consulté le )
- Adrian Forster et Andreas Krebs, « La goutte – ennuyeuse, mais traitable », Forum Médical Suisse ‒ Swiss Medical Forum, vol. 13, no 15, (ISSN 1661-6146 et 1661-6138, DOI 10.4414/fms.2013.01477, lire en ligne, consulté le )
- Nadir Hamel, « Tableau des aliments pauvres et riches en purines(400+ aliments) », sur guerirlagoutte.com, (consulté le )
- Tyson R. Chiaro & al. (2017) A member of the gut mycobiota modulates host purine metabolism exacerbating colitis in mice ; Science Translational Medicine 08 Mar 2017: Vol. 9, Issue 380, DOI: 10.1126/scitranslmed.aaf9044