Etilendiamina
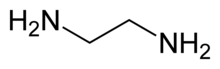
Etilendiamina (disingkat sebagai en ketika merupakan ligan) adalah senyawa organik dengan rumus C2H4(NH2)2. Cairan tak berwarna dengan bau seperti-amonia ini merupakan basa amina yang sangat kuat. Senyawa ini banyak digunakan sebagai blok pembangun dalam sintesis kimia, dengan sekira 500.000 ton senyawa ini diproduksi pada 1998.[6] Etilendiamina mudah bereaksi dengan kelembaban dalam udara lembab untuk menghasilkan suatu kabut korosif, beracun dan mengiritasi, yang bahkan pada paparan jangka pendeknya dapat menyebabkan penyakit yang serius (lihat bagian keamanan).[7] Etilendiamina adalah anggota pertama dari polietilena amina.
| |||
| |||

| |||
| Nama | |||
|---|---|---|---|
| Nama IUPAC (preferensi)
Etana-1,2-diamina | |||
| Nama IUPAC (sistematis)
Etana-1,2-diamina[2] | |||
| Nama lain
Edamina[1] 1,2-Diaminoetana, 'en' ketika merupakan ligan
| |||
| Penanda | |||
Model 3D (JSmol)
|
|||
| 3DMet | {{{3DMet}}} | ||
| Singkatan | en | ||
| Referensi Beilstein | 605263 | ||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| Nomor EC | |||
| Referensi Gmelin | 1098 | ||
| KEGG | |||
| MeSH | ethylenediamine | ||
PubChem CID
|
|||
| Nomor RTECS | {{{value}}} | ||
| UNII | |||
| Nomor UN | 1604 | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| Sifat | |||
| C2H8N2 | |||
| Massa molar | 60,10 g·mol−1 | ||
| Penampilan | Cairan tak berwarna[3] | ||
| Bau | Amoniakal[3] | ||
| Densitas | 0.90 g/cm3[3] | ||
| Titik lebur | 8 °C (46 °F; 281 K)[3] | ||
| Titik didih | 116 °C (241 °F; 389 K)[3] | ||
| larut | |||
| log P | −2.057 | ||
| Tekanan uap | 1.3 kPa (at 20 °C) | ||
| kH | 5.8 mol Pa−1 kg−1 | ||
| |||
| Indeks bias (nD) | 1.4565 | ||
| Termokimia | |||
| Kapasitas kalor (C) | 172.59 J K−1 mol−1 | ||
| Entropi molar standar (S |
202.42 J K−1 mol−1 | ||
| Entalpi pembentukan standar (ΔfH |
−63.55–−62.47 kJ mol−1 | ||
| Entalpi pembakaran standar ΔcH |
−1.8678–−1.8668 MJ mol−1 | ||
| Bahaya | |||
| Piktogram GHS |    
| ||
| Keterangan bahaya GHS | {{{value}}} | ||
| H226, H302, H312, H314, H317, H334 | |||
| P261, P280, P305+351+338, P310 | |||
| Titik nyala | 34 °C (93 °F; 307 K)[3] | ||
| 385 °C (725 °F; 658 K)[3] | |||
| Ambang ledakan | 2.7–16% | ||
| Dosis atau konsentrasi letal (LD, LC): | |||
LD50 (dosis median)
|
500 mg/kg (oral, rat) 470 mg/kg (oral, guinea pig) 1160 mg/kg (oral, rat)[5] | ||
| Batas imbas kesehatan AS (NIOSH): | |||
PEL (yang diperbolehkan)
|
TWA 10 ppm (25 mg/m3)[4] | ||
REL (yang direkomendasikan)
|
TWA 10 ppm (25 mg/m3)[4] | ||
IDLH (langsung berbahaya)
|
1000 ppm[4] | ||
| Senyawa terkait | |||
Related alkanamina
|
1,2-Diaminopropana, 1,3-Diaminopropana | ||
Senyawa terkait
|
Etilamina, Etilendinitramina | ||
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |||
| Referensi | |||
Sintesis
suntingEtilendiamina diproduksi secara industri dengan mereaksikan 1,2-dikloroetana dengan amonia di bawah tekanan 180 °C dalam medium berair:[6][8]
Dalam reaksi ini hidrogen klorida dihasilkan, yang membentuk garam dengan amina. Amina ini dilepaskan dengan penambahan natrium hidroksida dan dapat diperoleh kembali melalui rektifikasi. Dietilentriamina (DETA) dan trietilentetramina (TETA) dihasilkan sebagai produk samping.
Rute sintesis industri lainnya untuk menghasilkan etilendiamina melibatkan reaksi etanolamina dan amonia:[9]
Proses ini melibatkan reaktan gas yang dilewatkan pada hamparan katalis heterogen nikel.
Aplikasi
suntingEtilendiamina digunakan dalam jumlah besar dalam produksi banyak zat kimia industri. Senyawa ini membentuk turunan dengan asam karboksilat (termasuk asam lemak), nitril, alkohol (pada suhu tinggi), agen pengalkilasi, karbon disulfida, serta aldehida dan keton. Karena keadaan bifungsionalnya, yang memiliki dua gugus amina, senyawa ini mudah membentuk heterosiklik seperti imidazolidina.
Keamanan
suntingEtilendiamina, seperti amonia dan amina dengan berat molekul rendah, mampu mengiritasi kulit dan saluran pernapasan.[10] Apabila tidak disimpan dalam wadah yang tertutup rapat, etilendiamina cair akan melepas uap beracun dan mengiritasi ke lingkungan, terutama ketika dipanaskan. Uap tersebut bereaksi dengan kelembaban pada udara lembab untuk membentuk kabut putih, yang sangat mengiritasi kulit, mata, paru-paru dan membran mukosa.[11]
Referensi
sunting- ^ "32007R0129" (dalam bahasa Inggris). European Union. 12 Februari 2007. Annex II. Diakses tanggal 3 Mei 2012.
- ^ "ethylenediamine - Compound Summary". PubChem Compound (dalam bahasa Inggris). USA: National Center for Biotechnology Information. 16 September 2004. Identification and Related Records. Diakses tanggal 3 Mei 2012.
- ^ a b c d e f g Record dalam GESTIS Substance Database dari IFA
- ^ a b c "NIOSH Pocket Guide to Chemical Hazards #0269". National Institute for Occupational Safety and Health (NIOSH).
- ^ "Ethylenediamine". Immediately Dangerous to Life and Health. National Institute for Occupational Safety and Health (NIOSH).
- ^ a b Karsten Eller, Erhard Henkes, Roland Rossbacher, Hartmut Höke "Amines, Aliphatic" in Ullmann's Encyclopedia of Industrial Chemistry, 2005 Wiley-VCH Verlag, Weinheim. doi:10.1002/14356007.a02_001
- ^ "ChemWatch Review SDS: Ethylenediamine" (PDF). 12.1.1.1 (dalam bahasa Inggris). ChemWatch. 24 September 2013. Diakses tanggal 22 Januari 2019.
- ^ Hans-Jürgen Arpe, Industrielle Organische Chemie, 6. Auflage (2007), Seite 245, Wiley VCH
- ^ Hans-Jürgen Arpe, Industrielle Organische Chemie, 6. Auflage (2007), Seite 275, Wiley VCH
- ^ Fire Protection Guide to Hazardous Materials (dalam bahasa Inggris) (edisi ke-12). Quincy, MA: National Fire Protection Association. 1997. hlm. 49-69. OCLC 986313416.
- ^ Patty, Frank A. (1981–1982). Patty's Industrial Hygiene and Toxicology (dalam bahasa Inggris). Volume 2A, 2B, 2C: Toxicology (edisi ke-3). New York: John Wiley and Sons. hlm. 3163. ISBN 0-471-16042-3.
Pranala luar
suntingMedia tentang Etilendiamina di Wikimedia Commons