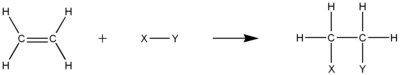Alkena

Alkena atau olefin dalam kimia organik adalah hidrokarbon tak jenuh dengan sebuah ikatan rangkap dua antara atom karbon.[1] Istilah alkena dan olefin sering digunakan secara bergantian (lihat bagian Tata nama di bawah). Alkena asiklik yang paling sederhana, yang membentuk satu ikatan rangkap dan tidak berikatan dengan gugus fungsional manapun, dikenal sebagai mono-ena, membentuk suatu deret homolog hidrokarbon dengan rumus umum CnH2n.[2] Alkena memiliki kekurangan dua atom hidrogen dibandingkan alkana terkait (dengan jumlah atom karbon yang sama). Alkena yang paling sederhana adalah etena atau etilena (C2H4) adalah senyawa organik terbesar yang diproduksi dalam skala industri.[3] Senyawa aromatik sering kali juga digambarkan seperti alkena siklik, tetapi struktur dan ciri-ciri mereka berbeda sehingga tidak dianggap sebagai alkena.[2]
Struktur
[sunting | sunting sumber]Ikatan
[sunting | sunting sumber]
Seperti ikatan kovalen tunggal, ikatan rangkap dapat digambarkan dalam bentuk orbital atom yang tumpang tindih, kecuali bahwa, tidak seperti ikatan tunggal (yang terdiri dari ikatan tunggal sigma), ikatan rangkap karbon–karbon terdiri dari satu ikatan sigma dan satu ikatan pi. Ikatan rangkap ini lebih kuat daripada ikatan kovalen tunggal (611 kJ/mol untuk C=C vs 347 kJ/mol untuk C–C)[1] dan juga lebih pendek, dengan panjang ikatan rata-rata 1,33 Ångström (133 pm).
Setiap karbon pada ikatan rangkap menggunakan tiga orbital hibrida sp2 untuk membentuk ikatan sigma ke tiga atom (satu karbon lainnya dan dua atom hidrogen). Orbital atom 2p yang tidak membentuk hibrida, yang tegak lurus terhadap bidang yang dibuat oleh sumbu tiga orbital hibrida sp², bergabung membentuk ikatan pi. Ikatan ini berada di luar sumbu utama C–C, dengan setengah ikatan di satu sisi molekul dan setengahnya di sisi lainnya.
Rotasi di sekitar ikatan rangkap karbon–karbon terbatas karena memerlukan energi besar untuk memutus kesejajaran orbital p pada dua atom karbon. Sebagai konsekuensinya, alkena tersubstitusi terdapat sebagai salah satu dari dua isomer, yang disebut isomer cis atau trans. Alkena yang lebih kompleks dapat diberi nama dengan notasi E–Z untuk molekul dengan tiga atau empat substituen (gugus samping) yang berbeda. Sebagai contoh, isomer butena, dua gugus metil (Z)-but-2-ena (alias cis-2-butena) muncul pada sisi yang sama dari ikatan rangkap, dan pada (E)-but-2-ena (alias trans-2-butena) gugus metil muncul pada sisi yang berlawanan. Kedua isomer butena ini sedikit berbeda dalam sifat kimia dan fisiknya.
Sebuah putaran 90° dari ikatan C=C (yang dapat ditentukan oleh posisi gugus fungsi yang terikat pada karbon) memerlukan lebih sedikit energi daripada kekuatan ikatan pi, sehingga ikatan dapat bertahan. Hal ni bertentangan dengan pernyataan umum pada buku teks bahwa orbital p tidak akan dapat mempertahankan ikatan semacam itu. Kenyataannya, penyimpangan orbital p kurang dari yang diharapkan karena terjadi piramidalisasi (lihat: alkena piramidal). trans-Siklooktena adalah alkena lurus yang stabil dan penyimpangan orbital hanya 19° dengan sudut dihedral 137° (normal 120°) serta tingkat piramidalisasi 18°.[4] Isomer trans sikloheptena hanya stabil pada suhu rendah.
Bentuk
[sunting | sunting sumber]Sesuai prediksi oleh model repulsi pasangan elektron VSEPR, geometri molekul alkena meliputi sudut ikatan di sekitar masing-masing karbon dalam ikatan rangkap berkisar 120°. Sudut bervariasi karena rantai sterik dipengaruhi oleh interaksi tak berikatan di antara gugus fungsi yang terikat pada karbon ikatan rangkap. Misalnya, sudut ikatan C-C-C dalam propilena adalah 123,9°.
Untuk alkena berjembatan, aturan Bredt menyatakan bahwa ikatan rangkap tidak dapat terjadi di pangkal jembatan sistem cincin kecuali jika cincinnya cukup besar (8 atau lebih atom).
Sifat fisika
[sunting | sunting sumber]Sifat fisika alkena tidak berbeda jauh dengan alkana. Mereka tidak berwarna, nonpolar, mudah terbakar, dan hampir tidak berbau. Perbandingan utama di antara keduanya adalah alkena mempunyai tingkat keasaman yang jauh lebih tinggi dibandingkan alkana. Wujud zat alkena tergantung dari massa molekulnya. Tiga alkena paling sederhana: etena, propena, dan butena berbentuk gas. Alkena linear yang memiliki 5 sampai 16 atom karbon berwujud cair, dan alkena yang memiliki atom karbon lebih dari 15 berwujud padat.
Reaksi
[sunting | sunting sumber]Alkena adalah senyawa yang relatif stabil, namun lebih reaktif daripada alkana, baik karena reaktivitas ikatan pi karbon-karbon atau adanya pusat CH alilik. Sebagian besar reaksi alkena melibatkan reaksi adisi pada ikatan pi ini, membentuk ikatan tunggal baru. Alkena berfungsi sebagai bahan baku industri petrokimia karena mereka dapat berperan dalam berbagai reaksi, terutama polimerisasi dan alkilasi.
Reaksi adisi
[sunting | sunting sumber]Alkena bereaksi dalam banyak reaksi adisi, yang berlangsung dengan membuka ikatan rangkap. Sebagian besar reaksi adisi ini mengikuti mekanisme adisi elektrofilik. Contohnya adalah hidrohalogenasi, halogenasi, pembentukan halohidrin, oksimerkurasi, hidroborasi, adisi diklorokarbena, reaksi Simmons-Smith, hidrogenasi katalitik, epoksidasi, polimerisasi radikal dan hidroksilasi.
Hidrogenasi
[sunting | sunting sumber]Hidrogenasi alkena menghasilkan alkana yang sesuai. Reaksi berlangsung di bawah tekanan pada temperatur 200 °C, dengan keberadaan katalis logam. Katalis yang umum digunakan di industri adalah yang berbasis platina, nikel atau paladium. Untuk sintesis skala laboratorium, sering digunakan nikel Raney (suatu logam paduan nikel dan aluminium). Contoh paling sederhana reaksi ini adalah hidrogenasi katalitik etilena untuk menghasilkan etana:
- CH2=CH2 + H → CH
Hidrasi
[sunting | sunting sumber]Hidrasi, penambahan air ke dalam ikatan ganda alkena, menghasilkan alkohol. Reaksi ini dikatalisis oleh asam kuat seperti asam sulfat. Reaksi ini dilakukan dalam skala industri untuk menghasilkan etanol.
- CH2=CH2 + H2O → CH3–CH2OH
Alkena dapat juga diubah menjadi alkohol melalui reaksi oksimerkurasi–demerkurasi atau reaksi hidroborasi–oksidasi.
Halogenasi
[sunting | sunting sumber]Dalam halogenasi elektrofilik, penambahan unsur brom atau klor pada alkena menghasilkan dibromo- dan dikloroalkana (1,2-dihalida atau etilen dihalida). Penghilangan warna larutan brom dalam air merupakan uji analitis untuk mengetahui keberadaan alkena:
- CH2=CH2 + Br2 → BrCH2–CH2Br
Reaksi terkait juga digunakan untuk pengujian kuantitatif terhadap ketidakjenuhan, yang dinyatakan sebagai nomor brom dan nomor iod suatu senyawa atau campuran.
Hidrohalogenasi
[sunting | sunting sumber]Hidrohalogenasi adalah adisi hidrogen halida seperti HCl atau HI pada alkena untuk menghasilkan haloalkana yang sesuai:
- CH3–CH=CH2 + HI → CH3–CHI-CH2–H
Jika dua atom karbon pada ikatan rangkap terhubung dengan atom hidrogen dalam jumlah yang berbeda, halogen akan memilih menyerang ataom karbon dengan substituen hidrogen yang lebih sedikit. Pola ini dikenal sebagai aturan Markovnikov. Penggunaan inisiator radikal atau senyawa lain dapat menghasilkan produk yang berlawanan. Asam hidrobromat, terutama, cenderung membentuk radikal dengan adanya berbagai ketakmurnian (impurities) atau bahkan oksigen di atmosfer, yang dapat membalikkan aturan Markovnikov:[5]
- CH3–CH=CH2 + HBr → CH3–CHH–CH2–Br
Pembentukan halohidrin
[sunting | sunting sumber]Alkena bereaksi dengan air dan halogen membentuk halohidrin melalui reaksi adisi. Terjadilah regiokimia Markovnikov dan anti stereokimia.
- CH2=CH2 + X2 + H2O → XCH2–CH2OH + HX
Oksidasi
[sunting | sunting sumber]Alkena dioksidasi dengan sejumlah besar oksidator. Dengan adanya oksigen, alkena terbakar dengan nyala terang menghasilkan karbon dioksida dan air. Oksidasi katalitik dengan oksigen atau reaksi dengan asam perkarboksilat menghasilkan epoksida. Reaksi dengan ozon pada ozonolisis menyebabkan pemutusan ikatan rangkap, menghasilkan dua aldehida atau keton. Reaksi dengan KMnO pekat panas (atau garam oksidator lainnya) dalam larutan asam akan menghasilkan keton atau asam karboksilat.
- R1–CH=CH–R2 + O3 → R1–CHO + R2–CHO + H2O
Reaksi ini dapat digunakan untuk menentukan posisi ikatan rangkap dalam suatu alkena yang tidak diketahui.
Oksidasi lebih mudah dihentikan pada diol yang bertetangga daripada memecah alkena secara penuh menggunakan KMnO yang lebih lunak (encer, temperatur lebih rendah) atau dengan osmium tetroksida atau oksidator lainnya.
Fotooksigenasi
[sunting | sunting sumber]Dengan adanya fotosensitiser yang sesuai, seperti metilen biru dan cahaya, alkena dapat bereaksi dengan spesies oksigen reaktif yang dihasilkan oleh fotosensitiser, seperti radikal hidroksil, oksigen singlet atau ion superoksida. Intermediat fotokimia yang dihasilkan ini kita kenal sebagai proses Type I, Type II, dan Type III. Berbagai proses dan reaksi alternatif ini dapat dikendalikan melalui pemilihan kondisi reaksi spesifik, sehingga memberikan rentang variasi produk yang luas. Contoh umum adalah [4+2]-sikloadisi oksigen singlet dengan diena seperti siklopentadiena untuk menghasilkan endoperoksida:
![Generation of singlet oxygen and its [4+2]-cycloaddition with cyclopentadiene](http://178.128.105.246/cars-http-upload.wikimedia.org/wikipedia/commons/thumb/1/12/4%2B2_cycloaddition_cyclopentadiene_O2.svg/350px-4%2B2_cycloaddition_cyclopentadiene_O2.svg.png)
Contoh lain adalah reaksi ena Schenck, yang mana oksigen singlet bereaksi dengan suatu struktur alilik untuk menghasilkan alil peroksida yang ditransposisikan:
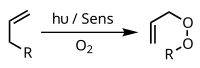
Polimerisasi
[sunting | sunting sumber]Polimerisasi alkena adalah reaksi yang menghasilkan polimer bernilai industrial tinggi namun ekonomis, seperti plastik (polietilena dan polipropilena). Polimer dari monomer alkena secara umum dirujuk sebagai poliolefin atau polialkena (istilah yang jarang digunakan). Polimer dari alfa-olefin disebut polialfaolefin (PAO). Polimerisasi dapat berlangsung baik melalui mekanisme radikal bebas maupun mekanisme ionik, dengan cara mengubah ikatan ganda menjadi ikatan tunggal untuk membentuk ikatan dengan monomer lainnya. Polimerisasi diena terkonjugasi seperti buta-1,3-diena atau isoprena (2-metilbuta-1,3-diena) sebagian besar menghasilkan adisi 1,4, dengan beberapa kemungkinan adisi 1,2, pada monomer diena untuk memperpanjang rantai polimer.
Kompleksasi logam
[sunting | sunting sumber]
Struktur bis(siklooktadiena)nickel(0), sebuah kompleks logam–alkena
Alkena adalah ligan dalam transisi kompleks logam alkena. Dua ikatan pusat karbon pada logam menggunakan orbital pi- dan pi*- ikatan C-C. Mono- dan diolefin sering digunakan sebagai ligan dalam kompleks yang stabil. Siklooktadiena dan norbordiena adalah senyawa pengkhelat populer, dan bahkan etilena itu sendiri terkadang digunakan sebagai ligan, misalnya, dalam garam Zeise. Selain itu, kompleks logam-alkena adalah senyawa antara dalam reaksi yang dikatalisis logam termasuk hidrogenasi, hidroformilasi, dan polimerisasi.
Ikhtisar reaksi
[sunting | sunting sumber]| Nama reaksi | Produk | Keterangan |
|---|---|---|
| Hidrogenasi | alkena | adisi hidrogen |
| Hidroalkenilasi | alkena | hidrometalasi / insersi / eliminasi beta oleh katalis logam |
| Reaksi adisi halogen | 1,2-dihalida | adisi elektrofilik halogen |
| Hidrohalogenasi (Markovnikov) | haloalkana | adisi asam halida |
| Anti-Markovnikov hidrohalogenasi | haloalkana | adisi asam halida yang dimediasi radikal bebas |
| Hidroaminasi | amina | adisi ikatan N-H pada ikatan rangkap C-C |
| Hidroformilasi | aldehida | proses industri, adisi CO dan H |
| Sharpless bishydroxylation | diol | oksidasi, pereaksi: osmium tetroksida, ligan khiral |
| Woodward cis-hydroxylation | diol | oksidasi, pereaksi: iodium, perak asetat |
| Ozonolisis | aldehida atau keton | pereaksi: ozon |
| Metatesis olefin | alkena | dua alkena menata ulang membentuk dua alkena baru |
| Reaksi Diels–Alder | sikloheksana | sikloadisi dengan diena |
| Reaksi Pauson–Khand | siklopentenon | sikloadisi dengan alkuna dan CO |
| Hidroborasi–oksidasi | alkohol | pereaksi: boran, disusul dengan peroksida |
| Reduksi oksimerkurasi | alkohol | adisi elektrofilik merkuri asetat, dilanjutkan dengan reduksi |
| Reaksi Prins | 1,3-diol | adisi elektrofilik dengan aldehida atau keton |
| Reaksi Paterno–Büchi | oksetana | reaksi fotokimia dengan aldehida atau keton |
| Epoksidasi | epoksida | adisi elektrofilik peroksida |
| Siklopropanasi | siklopropana | adisi karbena atau karbenoid |
| Hidroasilasi | keton | adisi oksidatif / eliminasi reduktif oleh katalis logam |
| Hidrofosfinasi | fosfin |
Sintesis
[sunting | sunting sumber]Metode industri
[sunting | sunting sumber]Alkena dihasilkan oleh perengkahan hidrokarbon. Bahan bakunya sebagian besar komponen kondensat gas alam (terutama etana dan propana) di AS dan Timur Tengah, dan nafta di Eropa dan Asia. Alkana dipecah pada suhu tinggi, sering kali dengan adanya katalis zeolit, untuk menghasilkan campuran alkena alifatik dan alkana dengan berat molekul rendah. Campurannya bergantung pada bahan baku dan suhu, dan dipisahkan dengan distilasi fraksi. Proses ini terutama digunakan untuk pembuatan alkena kecil (sampai enam karbon).[6]

Berkaitan dengan katalitik dehidrogenasi ini, alkana kehilangan hidrogen pada suhu tinggi untuk menghasilkan alkena yang sesuai.[1] Ini adalah kebalikan dari hidrogenasi katalitik alkena.
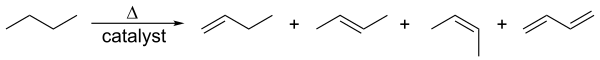
Proses ini juga dikenal sebagai pembentukan ulang berkatalis (catalytic reforming). Kedua proses bersifat endotermik dan didorong ke arah alkena pada suhu tinggi oleh entropi.
Sintesis katalitik α-alkena yang lebih tinggi (tipe RCH=CH2) juga dapat dicapai melalui reaksi etilena dengan senyawa organologam trietilaluminium dengan adanya nikel, kobalt, atau platina.
Reaksi eliminasi
[sunting | sunting sumber]Salah satu metode utama sintesis alkena di laboratorium adalah eliminasi alkil halida, alkohol, dan senyawa serupa. Yang paling umum adalah eliminasi β melalui mekanisme E2 atau E1,[7] tetapi eliminasi α juga dikenal.
Mekanisme E2 menyediakan metode eliminasi β yang lebih dapat diandalkan daripada E1 untuk kebanyakan sintesis alkena. Sebagian besar eliminasi E2 dimulai dengan alkil halida atau ester alkil sulfonat (seperti tosilat atau triflat). Bila digunakan alkil halida, reaksinya disebut dehidrohalogenasi. Untuk produk yang tidak simetris, semakin banyak substituen pada alkena (memiliki hidrogen menempel pada C=C lebih sedikit) cenderung mendominasi (lihat aturan Zaitsev). Dua metode umum reaksi eliminasi adalah dehidrohalogenasi alkil halida dan dehidrasi alkohol. Contohnya dapat dilihat pada reaksi di bawah ini. Perhatikan bahwa jika memungkinkan, H adalah anti terhadap gugus pergi, meskipun hal ini mengarah ke isomer Z yang kurang stabil.[8]
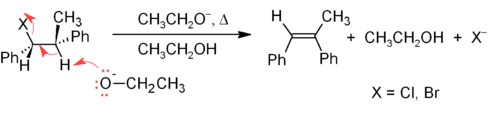
Alkena dapat disintesis dari alkohol melalui dehidrasi. Air dihilangkan melalui mekanisme E1. Sebagai contoh, dehidrasi etanol menghasilkan etena:
Alkohol dapat juga diubah menjadi suatu gugus pergi yang lebih baik (misal, xantat), sehingga memungkinkan eliminasi syn yang lebih ringan seperti eliminasi Chugaev dan eliminasi Grieco. Reaksi terkait meliputi eliminasi oleh haloeter β (sintesis olefin Boord) dan ester (pirolisis ester).
Alkena dapat dibuat secara tak langsung dari alkil amina. Amina atau amonia bukanlah gugus pergi yang sesuai, jadi pertama-tama amina dialkilasi (seperti dalam eliminasi Hofmann) atau dioksidasi menjadi amina oksida (reaksi Cope) untuk memungkinkan eliminasi berjalan lancar. Reaksi Cope adalah suatu eliminasi syn yang berlangsung pada suhu di bawah 150 °C. Sebagai contoh:[9]

Eliminasi Hofmann adalah reaksi yang tidak umum, biasanya produk utamanya adalah alkena non-Saytseff yang kurang tersubstitusi.
Alkena dapat dihasilkan dari α-halosulfon dalam reaksi Ramberg-Bäcklund, melalui zat antara sulfon cincin tiga.
Sintesis dari senyawa karbonil
[sunting | sunting sumber]Metode penting lainnya untuk sintesis akena melibatkan pembentukan ikatan rangkap baru karbon–karbon melalui reaksi kopling suatu senyawa karbonil (seperti aldehida atau keton) dengan karbanion ekivalennya. Reaksi semacam ini kadang-kadang disebut olefinasi. Metode yang paling terkenal adalah reaksi Wittig, meskipun ada pula metode lain yang diketahui.
Reaksi Wittig melibatkan reaksi suatu aldehida atau keton dengan pereaksi Wittig (atau fosforan) dari jenis Ph3P=CHR untuk menghasilkan alkena dan Ph3P=O. Pereaksi Wittig mudah disiapkan dari trifenilfosfin dan alkil halida. Reaksi bersifat umum dan banyak gugus fungsi yang dapat ditoleransi, bahkan ester sekalipun, seperti dalam contoh berikut:[10]
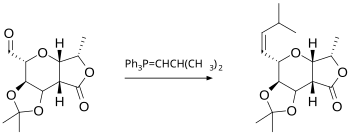
Olefinasi Peterson adalah reaksi yang terkait dengan reaksi Wittig. Ini menggunakan pereaksi berbasis silikon untuk menggantikan foforan, tetapi memungkinkan untuk memilih produk E atau Z. Jika diinginkan produk E, alfternatif lain adalah menggunakan olefinasi Julia, yang menggunakan karbanion yang dibentuk dari fenil sulfon. Olefinasi Takai yang mendasarkan reaksinya pada senyawa antara organokrom juga menghasilkan produk E. Sebuah senyawa titanium, pereaksi Tebbe, berguna untuk sintesis senyawa metilena; dalam hal ini, ester dan amida juga bereaksi.
Sepasang senyawa karbonil dapat pula dilakukan kopling (dengan reduksi) untuk menghasilkan alkena. Alkena simetris dapat dibuat dari aldehida atau keton tunggal dengan dirinya sendiri, menggunakan logam reduktor titanium (reaksi McMurry). Jika dilakukan kopling terhadap dua keton yang berbeda, digunakan metode tidak langsung dan lebih kompleks seperti reaksi Barton–Kellogg
Keton tunggal dapat juga diubah menjadi alkena yang sesuai melalui tosilhidrazon, menggunakan natrium metoksida (reaksi Bamford–Stevens atau alkillitium (reaksi Shapiro).
Disintesis dari alkena: metatesis olefin dan hidrovinilasi
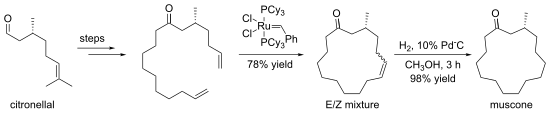
[sunting | sunting sumber]Alkena dapat dibuat melalui pertukaran dengan alkena lainnya, dalam suatu reaksi yang dikenal sebagai metatesis olefin. Seringkali, hilangnya gas etana digunakan untuk mendorong reaksi mengarah pada produk tertentu. Dalam beberapa kasus, diperoleh suatu campuran isomer geomtris, tetapi reaksi menoleransi banyak gugus fungsi. Metode ini efektif terutama untuk pembuatan alkena siklik, seperti dalam sintesis muskona (bahasa Inggris: muscone) berikut:
Hidrovinilasi yang dikatalisis logam transisi adalah proses sintesis alkena yang juga penting. Proses ini dimulai dari alkena itu sendiri.[11] Secara umum, ini melibatkan adisi hidrogen pada gugus vinil (atau gugus alkenil) di sekitar ikatan rangkap. Reaksi hidrovinilasi pertama kali dilaporkan oleh Alderson, Jenner, dan Lindsey menggunakan garam rhodium dan ruthenium. Katalis logam lain yang umum digunakan saat ini antara lain besi, kobalt, nikel, dan paladium. Penambahan dapat dilakukan secara stereoselektif atau regioselektif. Pemilihan pusat logam, ligan, substrat dan konterion sering kali memainkan peran penting.[12][13][14] Studi terkini menunjukkan bahwa penggunaan karbena N-heterosiklik dengan Ni dapat digunakan untuk preparasi selektif alkena dwisubstitusi-1,1.[15][16]
Disintesis dari alkuna
[sunting | sunting sumber]Reduksi alkuna adalah metode yang berguna untuk sintesis stereoselektif alkena dwisubstitusi. Jika diinginkan cis-alkena, hidrogenasi dengan katalis Lindlar (suatu katalis heterogen yang berisi deposit paladium pada kalsium karbonat dan diberi perlakuan dengan berbagai bentuk timbal) adalah metode yang umum digunakan, meskipun dapat pula dilakukan dengan hidroborasi yang diikuti hidrolisis sebagai metode alternatif. Reduksi alkuna oleh logam natrium dalam amonia cair menghasilkan trans-alkena.[17]
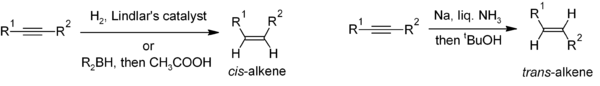
Untuk pembuatan alkena multisubstitusi, karbometalasi alkuna dapat meningkatkan ragam derivat alkena yang dihasilkan.
Penataan ulang dan reaksi terkait
[sunting | sunting sumber]Alkena dapat disintesis dari alkena lainnya melalui reaksi penataan ulang. Selain metatesis olefin (seperti dijelaskan di atas), sejumlah besar reaksi perisiklik dapat digunakan seperti reaksi ena dan penataan ulang Cope.
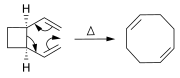
Pada reaksi Diels-Alder, derivat sikloheksana dibuat dari diena dan sebuah alkena yang reaktif atau kekurangan elektron.
Tata nama
[sunting | sunting sumber]Meskipun tata nama tidak diikuti secara luas, menurut IUPAC, alkena adalah hidrokarbon asiklik dengan satu ikatan rangkap antara pusat karbon. Olefin terdiri dari kumpulan alkil siklik dan asiklik yang lebih besar seperti diena dan poliena.[18]
Tata nama IUPAC
[sunting | sunting sumber]Untuk mengikuti tata nama IUPAC, maka seluruh alkena memiliki nama yang diakhiri -ena. Pada dasarnya, nama alkena diambil dari nama alkana dengan menggantikan akhiran -ana dengan -ena. C2H6 adalah alkana bernama etana sehingga C2H4 diberi nama etena.
Pada alkena yang memiliki isomer dengan perbedaan letak ikatan, digunakan penomoran dimulai dari ujung yang terdekat dengan ikatan tersebut sehingga atom karbon pada ikatan rangkap bernomor sekecil mungkin untuk membedakan isomernya. Contohnya adalah 1-heksena dan 2-heksena. Penamaan cabang sama dengan alkana.
Pada alkena yang lebih tinggi, di mana terdapat isomer yang letaknya berbeda dengan letak ikatan rangkap, maka sistem penomoran berikut ini dipakai:
- Beri nomor rantai karbon terpanjang yang memiliki ikatan rangkap, dimulai dari ujung yang terdekat dengan ikatan rangkap, sehingga atom karbon pada ikatan rangkap tersebut mempunyai nomor sekecil mungkin.
- Tentukan lokasi ikatan rangkap berdasarkan lokasi karbon pertamanya.
- Nama alkena bercabang atau alkena tersubstitusi sama seperti aturan pada alkana.
- Beri nomor atom karbon, tentukan lokasi dan nama gugus substituen, tentukan lokasi ikatan rangkap, dan beri nama rantai utama.

Notasi cis–trans
[sunting | sunting sumber]Khusus alkena dwisubstitusi di mana dua atom karbon masing-masing mempunyai satu substituen, maka notasi cis–trans dapat digunakan. Jika kedua substituen terletak pada sisi ikatan rangkap yang sama, maka disebut sebagai (cis-). Jika substituen terletak berseberangan, maka disebut sebagai (trans-).

Notasi E-Z
[sunting | sunting sumber]Jika suatu alkena memiliki lebih dari satu substituen (terutama 3 atau 4 substituen), geometri ikatan rangkap dinyatakan menggunakan label E dan Z. Label ini berasal dari bahasa German entgegen, yang berarti "berlawanan", dan zusammen, yang berarti "bersama-sama". Alkena dengan gugus prioritas lebih tinggi (seperti dijelaskan dalam aturan CIP) pada sisi yang sama diberi notasi Z. Alkena dengan gugus prioritas lebih tinggi yang terletak berseberangan diberi notasi E.

Gugus yang mengandung ikatan rangkap C=C
[sunting | sunting sumber]IUPAC memberi dua nama untuk gugus hidrokarbon yang mengandung ikatan rangkap karbon–karbon, gugus vinil dan gugus alil.[2]

Lihat pula
[sunting | sunting sumber]Bacaan lebih lanjut
[sunting | sunting sumber]- Hans Beyer, Wolfgang Walter: Lehrbuch der organischen Chemie. Hirzel Verlag, Stuttgart 2004, ISBN 3-7776-1221-9.
- Reinhard Brückner: Reaktionsmechanismen. Organische Reaktionen, Stereochemie, moderne Synthesemethoden. Spektrum Akademischer Verlag, Heidelberg 2004, ISBN 3-8274-1579-9.
- Ulfert Onken, Arno Behr: Chemische Prozeßkunde (Lehrbuch der technischen Chemie; 3). Georg Thieme Verlag, Stuttgart 1996, ISBN 3-13-687601-6.
- K. Peter C. Vollhardt, Niel E. Schore: Organische Chemie. Wiley-VCH, Weinheim 2005, ISBN 3-527-31380-X.
- Klaus Weissermel, Hans-Jürgen Arpe: Industrielle organische Chemie. Bedeutende Vor- und Zwischenprodukte. Wiley-VCH, Weinheim 1998, ISBN 3-527-28856-2.
- Rule A-3. Unsaturated Compounds and Univalent Radicals IUPAC Blue Book.
- Rule A-4. Bivalent and Multivalent Radicals IUPAC Blue Book.
- Rules A-11.3, A-11.4, A-11.5 Unsaturated monocyclic hydrocarbons and substituents IUPAC Blue Book.
- Rule A-23. Hydrogenated Compounds of Fused Polycyclic Hydrocarbons IUPAC Blue Book.
Referensi
[sunting | sunting sumber]
- ^ a b c Wade, L.G. (Sixth Ed., 2006). Organic Chemistry. Pearson Prentice Hall. hlm. 279. ISBN 1-4058-5345-X.
- ^ a b c Moss, G. P.; Smith, P. A. S.; Tavernier, D. (1995). "Glossary of class names of organic compounds and reactivity intermediates based on structure (IUPAC Recommendations 1995)". Pure and Applied Chemistry. 67 (8–9): 1307–1375. doi:10.1351/pac199567081307.
- ^ "Production: Growth is the Norm". Chemical and Engineering News. 84 (28): 59. July 10, 2006. doi:10.1021/cen-v084n034.p059.
- ^ Barrows, Susan E.; Eberlein, Thomas H. (2005). "Understanding Rotation about a C=C Double Bond". J. Chem. Educ. 82 (9): 1329. Bibcode:2005JChEd..82.1329B. doi:10.1021/ed082p1329.
- ^ Streiwieser, A.; Heathcock, C.H.; Kosower, E.M. (1992). "11.6.G. Alkenes: Reactions: Free Radical Additions". Introduction to Organic Chemistry (edisi ke-4th). New York: Macmillan. hlm. 288.
- ^ Wade, L.G. (2006). Organic Chemistry (edisi ke-6th). Pearson Prentice Hall. hlm. 309. ISBN 1-4058-5345-X.
- ^ Saunders, W. H. (1964). Patai, Saul, ed. The Chemistry of Alkenes. Wiley Interscience. hlm. 149–150.
- ^ Cram, D.J.; Greene, Frederick D.; Depuy, C. H. (1956). "Studies in Stereochemistry. XXV. Eclipsing Effects in the E2 Reaction1". Journal of the American Chemical Society. 78 (4): 790–796. doi:10.1021/ja01585a024.
- ^ Bach, R.D.; Andrzejewski, Denis; Dusold, Laurence R. (1973). "Mechanism of the Cope elimination". J. Org. Chem. 38 (9): 1742–3. doi:10.1021/jo00949a029.
- ^ Snider, Barry B.; Matsuo, Y; Snider, BB (2006). "Synthesis of ent-Thallusin". Org. Lett. 8 (10): 2123–6. doi:10.1021/ol0605777. PMC 2518398
 . PMID 16671797.
. PMID 16671797.
- ^ Vogt, D. (2010). "Cobalt-Catalyzed Asymmetric Hydrovinylation". Angew. Chem. Int. Ed. 49 (40): 7166–8. doi:10.1002/anie.201003133. PMID 20672269.
- ^ Grutters, M. M. P.; Muller, C.; Vogt, D. (2006). "Highly Selective Cobalt-Catalyzed Hydrovinylation of Styrene". J. Am. Chem. Soc. 128 (23): 7414–5. doi:10.1021/ja058095y. PMID 16756275.
- ^ Hilt, G.; Danz, M.; Treutwein, J. (2009). "Cobalt-Catalyzed 1,4-Hydrovinylation of Styrenes and 1-Aryl-1,3-butadienes". Org. Lett. 11 (15): 3322–5. doi:10.1021/ol901064p. PMID 19583205.
- ^ Sharma, R. K.; RajanBabu, T. V. (2010). "Asymmetric Hydrovinylation of Unactivated Linear 1,3-Dienes". J. Am. Chem. Soc. 132 (10): 3295–7. doi:10.1021/ja1004703. PMC 2836389
 . PMID 20163120.
. PMID 20163120.
- ^ Ho, C.-Y.; He, L. (2010). "Catalytic Intermolecular Tail-to-Tail Hydroalkenylation of Styrenes with alpha-Olefins: Regioselective Migratory Insertion Controlled by a Nickel/N-Heterocyclic Carbene". Angew. Chem. Int. Ed. 49 (48): 9182–9186. doi:10.1002/anie.201001849. PMID 20853303.
- ^ Ho, C.-Y.; He, L. (2012). "Shuffle Off the Classic Beta-Si Elimination by Ni-NHC Cooperation: Implication for C–C Forming Reactions Involving Ni-Alkyl-Beta-Silanes". Chem. Commun. 48 (10): 1481–1483. doi:10.1039/c1cc14593b. PMID 22116100.
- ^ Zweifel, George S.; Nantz, Michael H. (2007). Modern Organic Synthesis: An Introduction. New York: W. H. Freeman & Co. hlm. 366. ISBN 0-7167-7266-3.
- ^ Olefins, IUPAC Goldbook