Potasyum sülfat
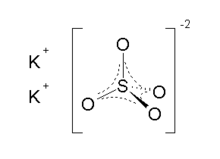
Potasyum sülfat, formülü K2SO4 olan, yanmaz, suda çözünebilen beyaz kristal yapıda bir potasyum tuzudur. Genellikle potasyum ve kükürt kaynağı olarak gübrelerde kullanılır.
 Arkanit
| |
| |
| Tanımlayıcılar | |
|---|---|
3D model (JSmol)
|
|
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| ECHA InfoCard | 100.029.013 |
| EC Numarası |
|
| E numaraları | E515(i) (asitliği düzenleyiciler, ...) |
| KEGG | |
PubChem CID
|
|
| RTECS numarası |
|
| UNII | |
CompTox Bilgi Panosu (EPA)
|
|
| |
| |
| Özellikler | |
| Molekül formülü | K2SO4 |
| Molekül kütlesi | 174.259 gr/mol |
| Görünüm | Beyaz katı |
| Koku | kokusuz |
| Yoğunluk | 2,66 gr/cm3[1] |
| Erime noktası | 1.069 °C (1.956 °F; 1.342 K) |
| Kaynama noktası | 1.689 °C (3.072 °F; 1.962 K) |
| Çözünürlük (su içinde) | 111 gr/L (20 °C) 120 gr/L (25 °C) 240 gr/L (100 °C) |
Çözünürlük ürünü (Ksp)
|
1,32 (120 g/L) |
| Çözünürlük | gliserinde çok az çözünür aseton, alkol, CS2de çözünmez |
| −67,0·10−6 cm3/mol | |
| Kırınım dizimi (nD) | 1,495 |
| Yapı | |
| ortorombik | |
| Tehlikeler | |
| İş sağlığı ve güvenliği (OHS/OSH): | |
| Ana tehlikeler | Tahriş edici |
| GHS etiketleme sistemi: | |
| Piktogramlar | 
|
| İşaret sözcüğü | Tehlike |
| R-ibareleri | R22 |
| G-ibareleri | S36 |
| Tehlike ifadeleri | H318 |
| Önlem ifadeleri | P280, P305+P351+P338, P310 |
| Parlama noktası | Yanıcı değildir |
| Öldürücü doz veya konsantrasyon (LD, LC): | |
LD50 (medyan doz)
|
6600 mg/kg (oral, sıçan)[2] |
| AB İndeksi | Listede yer almamaktadır |
| Güvenlik bilgi formu (SDS) | External MSDS |
| Benzeyen bileşikler | |
Diğer anyonlar
|
Potasyum selenat Potasyum tellürat |
Diğer katyonlar
|
Lityum sülfat Sodyum sülfat Rubidyum sülfat Sezyum sülfat |
Benzeyen
|
Potasyum bisülfat Potasyum sülfit Potasyum bisülfit Potasyum persülfat |
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa).
| |
| Bilgi kutusu kaynakları | |
Tarihi
değiştirPotasyum sülfat (K2SO4) 14. yüzyılın başlarından beri bilinmekteydi ve Johann Rudolf Glauber, Robert Boyle ve Tachenius tarafından araştırılmaktaydı. 17. yüzyılda, asit tuzu ile alkali tuzu kombinasyonundan oluştuğu için arcanuni veya sal duplicatum olarak adlandırılıyordu.[3][4]
Doğal kaynakları
değiştirPotasyum sülfatın mineral formu, arkanit, nispeten nadir bulunan bir mineraldir. Potasyum sülfatın doğal kaynakları Stassfurt tuzuunda bolca bulunan minerallerdir. Bu mineraller potasyum sülfat ve magnezyum, kalsiyum ve sodyum sülfatların kaynağıdır.
Bu mineraller:
- Kainit, MgSO4·KCl·H2O
- Schönit, K2SO4·MgSO4·6H2O
- Leonit, K2SO4·MgSO4·4H2O
- Langbeinit, K2SO4·2MgSO4
- Glaserit, K3Na(SO4)2
- Polihalit, K2SO4·MgSO4·2CaSO4·2H2O
Kainit gibi bazı minerallerden potasyum sülfat kolayca ayrılabilir çünkü içerdiği diğer tuzlar suda daha az çözünür.
Kieserit, MgSO4·2H2O, potasyum sülfat elde etmek için potasyum klorür çözeltisi ile karıştırılabilir.
Üretimi
değiştirPotasyum sülfatın üretim şekli sodyum sülfat üretimindekine benzerdir.
Potasyum sülfat, Nicolas Leblanc yöntemine göre potasyum klorürle sülfürik asit tepkimesinden elde edilebilir. Potasyum sülfat aşağıdaki reaksiyona göre üretilir.
- 2 KCl + H2SO4 → 2 HCl + K2SO4
Hargreaves(en) yöntemi potasyum sülfat üretimi için başlangıç materyali olarak kükürt dioksit, oksijen, su ve potasyum klorür kullanır. Hidroklorik asit buharlaşır. Kükürtün yanmasından SO2 üretilir.
Özellikleri
değiştirSusuz kristalleri çift 6-yüzlü piramit şeklindedir, fakat buna rağmen rombik olarak sınıflandırılır. Şeffaftır, acı, tuzlu bir tadı vardır. Bu tuz, suda çözünebilir ancak Potasyum hidroksit (yoğunluk 1,35) çözeltileri ve saf etanolde çözünmez. 1067 °C'de erir.[5]
Kullanımı
değiştirPotasyum sülfatın temel kullanımı gübre olaraktır. K2SO4, bazı bitkilere zararlı olabilecek klor içermez. Tütün, bazı meyveler ve sebzeler gibi klora duyarlı bitkiler için potasyum sülfat tercih edilir. Daha az duyarlı bitkiler de eğer toprakta sulama suyundan kaynaklanan klor birikmesi varsa yine de optimum gelişme için potasyum sülfat gerektirebilir.[6]
İşlenmemiş potasyum sülfat tuzu bazen cam yapımında da kullanılır.
Potasyum hidrojen sülfat
değiştirPotasyum hidrojen sülfat veya bisülfat, KHSO4, K2SO4 ve eşit mol sülfürik asit ile kolayca üretilebilir. 197 °C'de eriyen rombik piramit yapı oluşturur.
Yararlanılan kaynaklar
değiştir- ^ Patnaik, Pradyot (2002). Handbook of Inorganic Chemicals. McGraw-Hill. ISBN 0-07-049439-8.
- ^ "Arşivlenmiş kopya". 12 Ağustos 2014 tarihinde kaynağından arşivlendi. Erişim tarihi: 26 Eylül 2015.
- ^ De Milt, Clara (1942). "Christopher Glaser". Journal of Chemical Education. 19 (2). s. 53. doi:10.1021/ed019p53.
- ^ Klooster, van (1959). "Three centuries of Rochelle salt". Journal of Chemical Education. 36 (7). s. 314. doi:10.1021/ed036p314.
- ^ Windholtz, M(Ed.)& Budavari, S (Ed). (1983). The Merck Index, Rahay: Merck & Co.
- ^ Fertilizer manual (3rd ed. bas.). Dordrecht: Kluwer academic publ. 1998. s. 615. ISBN 0-7923-5032-4.
Dış bağlantılar
değiştir- mindat.org: Arcanite 9 Kasım 2011 tarihinde Wayback Machine sitesinde arşivlendi.
- webmineral: Arcanite 9 Aralık 2011 tarihinde Wayback Machine sitesinde arşivlendi.