Configuración electronica
| Iste articlo ye en proceso de cambio enta la ortografía oficial de Biquipedia (la Ortografía de l'aragonés de l'Academia Aragonesa d'a Luenga). Puez aduyar a completar este proceso revisando l'articlo, fendo-ie los cambios ortograficos necesarios y sacando dimpués ista plantilla. |

O termin confeguración electronica, se fa servir en quimica ta referir-se a la distribución d'os electrons, en os orbitals arredol d'o nuclio d'un u mas atomos.
Orbitals, estaus y funcions d'onda
[editar | modificar o codigo]Como os electrons son fermions, son chusmesos a o Prencipio d'exclusión de Pauli, que diz que dos fermions no pueden ocupar o mesmo estau cuantico a la vegada. Ista ye a regla fundamental que determina a colocación d'os electrons en un atomo. Una vegada que un electrón ha ocupato un estau, o sigüient electrón ha d'ocupar un estau mecanocuantico diferent.
En un atomo, os estaus estacionarios d'a función d'onda d'un electrón (os estaus que son función propia d'a ecuación de Schrödinger HΨ = IΨ a on H ye o hamiltoniano) se denominan orbitals, por analochía con a clasica imachen d'os electrons orbitando arredol d'o nuclio. Istos estaus tienen cuatre numeros cuanticos: n, l, ml y ms, y, en resumen, o prencipio de Pauli quiere decir que no puet haber dos electrons en un mesmo atomo con as cuatre valuras d'os numeros cuanticos iguals. Os mas importants d'istos son o n y o l.
Valuras d'os numeros cuanticos
[editar | modificar o codigo]O primer numero cuantico n (dito tamién numero cuantico prencipal) corresponde a os diferents nivels d'enerchía permititos u nivels cuanticos; as valuras que prene son 1, 2, 3, 4,... Ta n=1 se tien o nivel de menor enerchía. En bels casos (por eixemplo en espectroscopia de rayos X) tamién se denotan como K, L, M, N,...
O segundo numero cuantico l corresponde a o momento angular d'o estau. Istos estaus tienen a forma d'harmanicos esfericos, y por tanto se describen emplegando polinomios de Legendre. A istos subnivels, por razons historicas, se les asigna una letra, y fan referencia a o tipo d'orbital (s, p, d, f, g):
| Valura de l | Orbital | Maximo numero d'electrons |
|---|---|---|
| 0 | s | 2 |
| 1 | p | 6 |
| 2 | d | 10 |
| 3 | f | 14 |
| 4 | g | 18 |
As valuras que puet prener l son: 0,..., (n-1), estando n o numero cuantico prencipal.
O tercer numero cuantico, m, puet prener as valuras dende -l a l, y por tanto bi ha un total de 2l+1 estaus posibles.
Cadagún d'istos puet estar ocupato por dos electrons con espins oposatos, lo que viene dato por o cuatreno numero cuantico s (spin), que puet valer +1/2 o -1/2. Isto da un total de 2(2l+1) electrons en total (tal como se puet veyer en a tabla anterior).
En resumen, istas son as valuras que pueden prener os numeros cuanticos:
| Numero cuantico | Valuras posibles |
|---|---|
| n | 1, 2, 3,... |
| l | 0,..., (n-1) |
| m | -l,..., 0,...,+l |
| s | -1/2, +1/2 |
Por eixemplo en o caso d'o helio (2 electrons), en a suya confeguración electronica habitual, contendrá 2 electrons con os sigüients numeros cuanticos;
| n | l | m | s | Orbital |
|---|---|---|---|---|
| 1 | 0 | 0 | -1/2 | 1s |
| 1 | 0 | 0 | +1/2 |
En o caso d'o neón (10 electrons), tendremos as sigüients valuras posibles ta os numeros cuanticos;
| n | l | m | s | Orbital |
|---|---|---|---|---|
| 1 | 0 | 0 | -1/2 | 1s |
| 1 | 0 | 0 | +1/2 | |
| 2 | 0 | 0 | -1/2 | 2s |
| 2 | 0 | 0 | +1/2 | |
| 2 | 1 | -1 | -1/2 | 2p |
| 2 | 1 | -1 | +1/2 | |
| 2 | 1 | 0 | -1/2 | |
| 2 | 1 | 0 | +1/2 | |
| 2 | 1 | 1 | -1/2 | |
| 2 | 1 | 1 | +1/2 |
Notación
[editar | modificar o codigo]Se fa servir una notación estandar ta describir as confeguracions electronicas d'os atomos. En ista notación, cada subcapa ye descrita con a notación nxe a on;
- n ye o numero de capa y se corresponde con o numero cuantico prencipal.
- x ye o tipo de subcapa y ye o simbolo d'o segundo numero cuantico.
- y e ye o numero d'electrons que contiene a subcapa.
As subcapas d'un atomo siempre se describen en orden d'enerchía creixient (Prencipio d'Aufbau).
Prencipio d'Aufbau
[editar | modificar o codigo]En o estau no excitato d'un atomo (o estau mas normal), a confeguración electronica sigue o Prencipio d'Aufbau. Seguntes iste prencipio, os electrons dentran en os orbitals, en orden d'enerchía creixient. Ye decir, o primer electrón d'un atomo, se coloca en l'orbital de menor enerchía, o segundo en o sigüient menos enerchetico, y asinas asinas. De contino s'amuestra una tabla con l'orden en que s'implen os orbitals.
| s | (maximo 2e-) | 1º | 2º | 4eno | 6eno | 9eno | 12eno | 16eno | 20eno |
|---|---|---|---|---|---|---|---|---|---|
| (maximo 6e-) | 3º | 5eno | 8eno | 11eno | 15eno | 19eno | 24eno | ||
| (maximo 10e-) | 7eno | 10eno | 14eno | 18eno | 23eno | ||||
| (maximo 14e-) | 13eno | 17eno | 22eno | ||||||
| (maximo 18e-) | 21eno |
Emplenato d'orbitals
[editar | modificar o codigo]Ta obtener a confeguración electronica d'un elemento, os estaus se van ocupando por electrons seguntes a enerchía d'istos estaus: primero s'ocupan os de menor enerchía. Como o estau 3d (n=3 y l=2) ye mas enerchetico que o 4s (n=4 y l=0), existen os metals de transición; y como en l'orbital d i cullen 10 electrons seguntes a primera tabla (u bien fendo l=2 en 2(2l+1)=10), bi ha diez elementos en cada serie de transición. O mesmo alcurre con atros bloques d'elementos que se pueden veyer en a tabla periodica d'os elementos.

Se gosa emplegar una regla mnemotecnica en que se fa una tabla a on en a primera fila s'escribe 1s, 2s, 3s,..., en a segunda fila, brincando una columna, 2p, 3p,... y asinas succesivament. Os primers nivels que se van emplindo con electrons son os que queden mas a la ezquierda y abaixo d'a tabla.
Concretament, en o diagrama s'implen dica o 3d, prencipiando por a primera serie de transición. Si por eixemplo se quiere saber a confeguración electronica d'o vanadio, con o diagrama obtendríanos:
- 1s2 2s2 2p6 3s2 3p6 4s2 3d3
A on o primer numero ye o numero cuantico prencipal, a letra ye o segundo (tipo d'orbital) y o superendiz ye o numero d'electrons que son en iste nivel (os termins anteriors s'ordenan dimpués seguindo l'orden d'o numero cuantico prencipal).
En tractar-se d'o vanadio cal meter 23 electrons. En cada orbital s en i cullen 2; en os p, 6 y en os d, 10. O zaguer orbital nomás tendría 3 electrons por o que no sería pleno. Manimenos, existen bellas excepcions d'elementos que no siguen de tota ista regla, por eixemplo o cromo, con un electrón mas, 3d54s1 (se veiga confeguración electronica d'os elementos quimicos).
Una atra notació menos emplegata, ye a d'indicar ordenadament o numero d'electrons que bi ha en cada nivel, por eixemplo en o silicio sería: 2 8 4. O primer 2 equivale a 1s2, o 8 equivale a 2s2 2p6 y o 4 equivale a 3s2 3p2
Bloques d'a tabla periodica
[editar | modificar o codigo]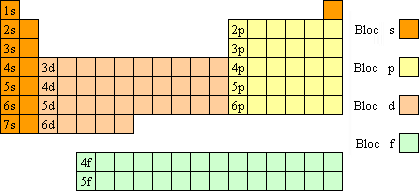
As propiedaz quimicas d'un atomo penden muito de como son ordenatos os electrons en os orbitals de mas enerchía (a vegadas ditos de valencia), a parti d'atros factors como o radio atomico, a masa atomica, u l'acesibilidat d'atros estaus electronicos.
En baixar por un grupo d'elementos, dende o mas lichero dica o mas pesato, os electrons mas externos, en nivels d'enerchía mas altos, y que por tanto ye mas fácil que faigan parti en as reaccions quimicas, son en o mesmo orbital, con una forma parellana, pero con una enerchía y distancia a o nuclio mayors. Por eixemplo, o carbonio y o plomo tienen cuatre electrons en os suyos orbitals mas externos.
A causa d'a importancia d'os nivels enercheticos mas exteriors, as diferents rechions d'a tabla periodica se dividen en bloques, dencindo-se seguntes o zaguer nivel ocupato: elementos d'o bloque s, elementos d'o bloque p, elementos d'o bloque d y elementos d'o bloque f, tal y como se veye en o diagrama.
Regla de l'octeto
[editar | modificar o codigo]Ta que un atomo sía estable ha de tener toz os suyos orbitals plenos (cada orbital con dos electrons, un d'espín +1/2 y altro d'espín -1/2). Por eixemplo, l'oxicheno, que tien confeguración electronica 1s2, 2s2, 2p4, ye mas estable si plega a la confeguración 1s2, 2s2, 2p6 con o que, os nivels 1 y 2 serían plenos. Alavez l'oxicheno tendrá tendencia a ganar os 2 electrons que le mancan.
D'atra man, o hidrocheno, tien un electrón en a capa de valencia. Y por tanto tien u bien tendencia a liberar-lo ta quedar-se sin él u bien ta capturar-ne un atro ta emplir o nivel 1s.
Por ixo l'oxicheno y o hidrocheno se combinan ta formar augua, cada atomo d'hidrocheno cede un electrón d'o suyo nivel 1s que utiliza l'oxicheno ta rematar d'emplir o suyo nivel 2p dica os 6 electrons. Como l'afinidat d'os dos elementos por os electrons (electronegatividat) ye parellana, se forma un enlace covalent y os dos atomos comparten os electrons ceditos por o hidrocheno.
Un atro eixemplo: en o cloruro sodico, o cloro tien muita tendencia a ganar un electrón ta replenar o suyo orbital 3p. Por l'atro costato, o sodio tien muita tendencia a ceder un electrón ta quedar-se con l'orbital 2p pleno. Por tanto a combinación de cloro y sodio chenera un enlace ionico, a on os electrons no se comparten, sino que son ceditos de tot, ya que o sodio se queda con un electrón de menos y o cloro con un electrón de mas.
Moleculas
[editar | modificar o codigo]En as moleculas cal tractar con os orbitals moleculars. Se conoixe como molecula a la unión d'atomos no metalicos, os cuals ta tener cantidat d'electrons exteriors muit amanatas a l'octeto, tienen una alta electronegatividat, por tanto tienden a atrayer electrons (a diferencia d'os metals que tienden a perder-los) y por tanto, si se troban con un atro atomo no metalico compartirán electrons dica que os dos puedan tener os 8 electrons en a capa de valencia. Iste tipo d'unión se diz covalent y ye a mas fuerte conoixita por a ciencia (superior a la fuerza d'atracción metalica, ionica, polar, etc.). Ta meter un eixemplo, o material mas duro y resistent d'a naturaleza, o diamant, ye un rete d'atomos de carbonio unitos entre si por unions covalents. Ta gosar crebar istas unions s'amenista fer calentar o diamant a alto u baxo 6273K.
Se veiga tamién
[editar | modificar o codigo]Bibliografía
[editar | modificar o codigo]- Boeyens, Jan C. A.: Chemistry from First Principles. Berlin: Springer Science 2008, ISBN 978-1-4020-8546-8.
Vinclos externos
[editar | modificar o codigo] Se veigan as imáchens de Commons sobre a confeguración electronica.
Se veigan as imáchens de Commons sobre a confeguración electronica.












