„Dischwefeldioxid“ – Versionsunterschied
| [gesichtete Version] | [gesichtete Version] |
Rjh (Diskussion | Beiträge) →Einleitung: NV |
JWBE (Diskussion | Beiträge) - ISSN |
||
| Zeile 32: | Zeile 32: | ||
== Struktur == |
== Struktur == |
||
Dischwefeldioxid nimmt eine [[Cis-trans-Isomerie|''cis'']]-planare Struktur mit ''C''<sub>2v</sub>-[[Molekülsymmetrie|Symmetrie]] an. Die [[Bindungslänge]] zwischen Schwefel und Sauerstoff im Molekül beträgt 145,8 [[Pikometer|pm]], kürzer als die in [[Schwefelmonoxid]]. Der Abstand zwischen den zwei Schwefelatomen im Molekül beträgt hingegen 202,45 pm.<ref name=":0">{{Literatur |Autor=F. J. Lovas, E. Tiemann, D. R. Johnson |Titel=Spectroscopic studies of the SO<sub>2</sub> discharge system. II. Microwave spectrum of the SO dimer |Sammelwerk=The Journal of Chemical Physics |Band=60 |Nummer=12 |Datum=1974-06-15 |
Dischwefeldioxid nimmt eine [[Cis-trans-Isomerie|''cis'']]-planare Struktur mit ''C''<sub>2v</sub>-[[Molekülsymmetrie|Symmetrie]] an. Die [[Bindungslänge]] zwischen Schwefel und Sauerstoff im Molekül beträgt 145,8 [[Pikometer|pm]], kürzer als die in [[Schwefelmonoxid]]. Der Abstand zwischen den zwei Schwefelatomen im Molekül beträgt hingegen 202,45 pm.<ref name=":0">{{Literatur |Autor=F. J. Lovas, E. Tiemann, D. R. Johnson |Titel=Spectroscopic studies of the SO<sub>2</sub> discharge system. II. Microwave spectrum of the SO dimer |Sammelwerk=The Journal of Chemical Physics |Band=60 |Nummer=12 |Datum=1974-06-15 |DOI=10.1063/1.1681015 |Seiten=5005–5010 }}</ref><ref>{{Literatur |Autor=J. Vogt |Titel=836 O<sub>2</sub>S<sub>2</sub> Disulfur dioxide |Sammelwerk=Asymmetric Top Molecules. Part 3 |Band=29D3 |Verlag=Springer Berlin Heidelberg |Ort=Berlin, Heidelberg |Datum=2011 |ISBN=978-3-642-14144-7 |DOI=10.1007/978-3-642-14145-4_258 |Seiten=492–492 |Online=http://materials.springer.com/lb/docs/sm_lbs_978-3-642-14145-4_258 |Abruf=2024-07-01}}</ref><ref name=":1">{{Literatur |Autor=S. Thorwirth, P. Theulé, C.A. Gottlieb, H.S.P. Müller, M.C. McCarthy, P. Thaddeus |Titel=Rotational spectroscopy of S<sub>2</sub>O: Vibrational satellites, 33S isotopomers, and the sub-millimeter-wave spectrum |Sammelwerk=Journal of Molecular Structure |Band=795 |Nummer=1-3 |Datum=2006-08 |DOI=10.1016/j.molstruc.2006.02.055 |Seiten=219–229 |Online=https://linkinghub.elsevier.com/retrieve/pii/S0022286006002456 |Abruf=2024-07-01}}</ref> |
||
== Bildung == |
== Bildung == |
||
[[Schwefelmonoxid]] kann sich spontan und reversibel in Dischwefeldioxid umwandeln.<ref name=":0" /> Der Stoff kann also durch Methoden erzeugt werden, bei denen Schwefelmonoxid entsteht.<ref name=":1" /> |
[[Schwefelmonoxid]] kann sich spontan und reversibel in Dischwefeldioxid umwandeln.<ref name=":0" /> Der Stoff kann also durch Methoden erzeugt werden, bei denen Schwefelmonoxid entsteht.<ref name=":1" /> |
||
Eine weitere Methode ist, Sauerstoffatome mit [[Carbonylsulfid]] und [[Kohlenstoffdisulfid]] zur Reaktion zu bringen.<ref name=":2">{{Literatur |Autor=Bing-Ming Cheng, Wen-Ching Hung |Titel=Photoionization efficiency spectrum and ionization energy of S<sub>2</sub>O<sub>2</sub> |Sammelwerk=The Journal of Chemical Physics |Band=110 |Nummer=1 |Datum=1999-01-01 |
Eine weitere Methode ist, Sauerstoffatome mit [[Carbonylsulfid]] und [[Kohlenstoffdisulfid]] zur Reaktion zu bringen.<ref name=":2">{{Literatur |Autor=Bing-Ming Cheng, Wen-Ching Hung |Titel=Photoionization efficiency spectrum and ionization energy of S<sub>2</sub>O<sub>2</sub> |Sammelwerk=The Journal of Chemical Physics |Band=110 |Nummer=1 |Datum=1999-01-01 |DOI=10.1063/1.478094 |Seiten=188–191 }}</ref> Dischwefeldioxid entsteht auch bei einer Mikrowellenentladung in in [[Helium]] verdünntem [[Schwefeldioxid]].<ref>{{Literatur |Autor=T A Field, A E Slattery, D J Adams, D D Morrison |Titel=Experimental observation of dissociative electron attachment to S<sub>2</sub>O and S<sub>2</sub>O<sub>2</sub> with a new spectrometer for unstable molecules |Sammelwerk=Journal of Physics B: Atomic, Molecular and Optical Physics |Band=38 |Nummer=3 |Datum=2005-02-14 |DOI=10.1088/0953-4075/38/3/009 |Seiten=255–264 }}</ref> Bei einem Druck von 13 [[Pascal (Einheit)|Pa]] sind 5 % des resultierenden Stoffes Dischwefeldioxid.<ref>{{Literatur |Autor=Balaram Sahoo, Nayak Nimai Charan, Samantaray Asutosh, Pujapanda Prafulla Kumar |Titel=Inorganic Chemistry |Verlag=PHI Learning |Datum=2012 |Sprache=en |ISBN=9788120343085}}</ref> |
||
Dischwefeldioxid entsteht vorübergehend, wenn [[Schwefelwasserstoff]] und Sauerstoff einer [[Blitzphotolyse]] unterliegen.<ref>{{Literatur |Titel=Reactions of Non-Metallic Inorganic Compounds |Verlag=Elsevier Science |Datum=2014-05-14 |Sprache=en |ISBN=9780080868011}}</ref> |
Dischwefeldioxid entsteht vorübergehend, wenn [[Schwefelwasserstoff]] und Sauerstoff einer [[Blitzphotolyse]] unterliegen.<ref>{{Literatur |Titel=Reactions of Non-Metallic Inorganic Compounds |Verlag=Elsevier Science |Datum=2014-05-14 |Sprache=en |ISBN=9780080868011}}</ref> |
||
| Zeile 44: | Zeile 44: | ||
Die [[Ionisierungsenergie]] von Dischwefeldioxid ist 9,93 ± 0,02 [[Elektronenvolt|eV]].<ref name=":2" /> |
Die [[Ionisierungsenergie]] von Dischwefeldioxid ist 9,93 ± 0,02 [[Elektronenvolt|eV]].<ref name=":2" /> |
||
Dischwefeldioxid absorbiert bei 320–400 [[Nanometer|nm]], wie in der [[Venus (Planet)#Atmosphäre|Venusatmosphäre]] beobachtet, und es wird angenommen, dass es zum [[Treibhauseffekt]] auf dem Planeten beigetragen hat.<ref>{{Literatur |Autor=Benjamin N. Frandsen, Paul O. Wennberg, Henrik G. Kjaergaard |Titel=Identification of OSSO as a near‐UV absorber in the Venusian atmosphere |Sammelwerk=Geophysical Research Letters |Band=43 |Nummer=21 |Datum=2016-11-16 |
Dischwefeldioxid absorbiert bei 320–400 [[Nanometer|nm]], wie in der [[Venus (Planet)#Atmosphäre|Venusatmosphäre]] beobachtet, und es wird angenommen, dass es zum [[Treibhauseffekt]] auf dem Planeten beigetragen hat.<ref>{{Literatur |Autor=Benjamin N. Frandsen, Paul O. Wennberg, Henrik G. Kjaergaard |Titel=Identification of OSSO as a near‐UV absorber in the Venusian atmosphere |Sammelwerk=Geophysical Research Letters |Band=43 |Nummer=21 |Datum=2016-11-16 |DOI=10.1002/2016GL070916 }}</ref><ref>{{Internetquelle |url=https://www.cbc.ca/news/science/rare-molecule-venus-weather-1.3843428 |titel=Rare molecule on Venus may help explain planet's weather |werk=CBC |datum=2016-10-09 |sprache=en |abruf=2024-07-01}}</ref> Es kommt in der [[Erdatmosphäre]] nicht in nennenswerten Mengen vor. |
||
== Weblinks == |
== Weblinks == |
||
Version vom 5. Juli 2024, 13:05 Uhr
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
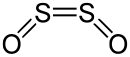
| ||||||||||
| Allgemeines | ||||||||||
| Name | Dischwefeldioxid | |||||||||
| Andere Namen |
Dischwefel(II)-oxid | |||||||||
| Summenformel | S2O2 | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 96,13 g·mol−1 | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||
Dischwefeldioxid (S2O2) ist ein instabiles[2] Schwefeloxid, welches aus zwei Schwefelatomen und zwei Sauerstoffatomen besteht.[3]
Struktur
Dischwefeldioxid nimmt eine cis-planare Struktur mit C2v-Symmetrie an. Die Bindungslänge zwischen Schwefel und Sauerstoff im Molekül beträgt 145,8 pm, kürzer als die in Schwefelmonoxid. Der Abstand zwischen den zwei Schwefelatomen im Molekül beträgt hingegen 202,45 pm.[4][5][6]
Bildung
Schwefelmonoxid kann sich spontan und reversibel in Dischwefeldioxid umwandeln.[4] Der Stoff kann also durch Methoden erzeugt werden, bei denen Schwefelmonoxid entsteht.[6]
Eine weitere Methode ist, Sauerstoffatome mit Carbonylsulfid und Kohlenstoffdisulfid zur Reaktion zu bringen.[7] Dischwefeldioxid entsteht auch bei einer Mikrowellenentladung in in Helium verdünntem Schwefeldioxid.[8] Bei einem Druck von 13 Pa sind 5 % des resultierenden Stoffes Dischwefeldioxid.[9]
Dischwefeldioxid entsteht vorübergehend, wenn Schwefelwasserstoff und Sauerstoff einer Blitzphotolyse unterliegen.[10]
Eigenschaften
Die Ionisierungsenergie von Dischwefeldioxid ist 9,93 ± 0,02 eV.[7]
Dischwefeldioxid absorbiert bei 320–400 nm, wie in der Venusatmosphäre beobachtet, und es wird angenommen, dass es zum Treibhauseffekt auf dem Planeten beigetragen hat.[11][12] Es kommt in der Erdatmosphäre nicht in nennenswerten Mengen vor.
Weblinks
Einzelnachweise
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Biological Interactions Of Sulfur Compounds. Taylor & Francis, 2003, ISBN 978-0-203-36252-5 (englisch).
- ↑ Holleman-Wiberg inorganic chemistry. Academic, San Diego, Calif. London 2001, ISBN 978-0-12-352651-9.
- ↑ a b F. J. Lovas, E. Tiemann, D. R. Johnson: Spectroscopic studies of the SO2 discharge system. II. Microwave spectrum of the SO dimer. In: The Journal of Chemical Physics. Band 60, Nr. 12, 15. Juni 1974, S. 5005–5010, doi:10.1063/1.1681015.
- ↑ J. Vogt: 836 O2S2 Disulfur dioxide. In: Asymmetric Top Molecules. Part 3. 29D3. Springer Berlin Heidelberg, Berlin, Heidelberg 2011, ISBN 978-3-642-14144-7, S. 492–492, doi:10.1007/978-3-642-14145-4_258 (springer.com [abgerufen am 1. Juli 2024]).
- ↑ a b S. Thorwirth, P. Theulé, C.A. Gottlieb, H.S.P. Müller, M.C. McCarthy, P. Thaddeus: Rotational spectroscopy of S2O: Vibrational satellites, 33S isotopomers, and the sub-millimeter-wave spectrum. In: Journal of Molecular Structure. Band 795, Nr. 1-3, August 2006, S. 219–229, doi:10.1016/j.molstruc.2006.02.055 (elsevier.com [abgerufen am 1. Juli 2024]).
- ↑ a b Bing-Ming Cheng, Wen-Ching Hung: Photoionization efficiency spectrum and ionization energy of S2O2. In: The Journal of Chemical Physics. Band 110, Nr. 1, 1. Januar 1999, S. 188–191, doi:10.1063/1.478094.
- ↑ T A Field, A E Slattery, D J Adams, D D Morrison: Experimental observation of dissociative electron attachment to S2O and S2O2 with a new spectrometer for unstable molecules. In: Journal of Physics B: Atomic, Molecular and Optical Physics. Band 38, Nr. 3, 14. Februar 2005, S. 255–264, doi:10.1088/0953-4075/38/3/009.
- ↑ Balaram Sahoo, Nayak Nimai Charan, Samantaray Asutosh, Pujapanda Prafulla Kumar: Inorganic Chemistry. PHI Learning, 2012, ISBN 978-81-203-4308-5 (englisch).
- ↑ Reactions of Non-Metallic Inorganic Compounds. Elsevier Science, 2014, ISBN 978-0-08-086801-1 (englisch).
- ↑ Benjamin N. Frandsen, Paul O. Wennberg, Henrik G. Kjaergaard: Identification of OSSO as a near‐UV absorber in the Venusian atmosphere. In: Geophysical Research Letters. Band 43, Nr. 21, 16. November 2016, doi:10.1002/2016GL070916.
- ↑ Rare molecule on Venus may help explain planet's weather. In: CBC. 9. Oktober 2016, abgerufen am 1. Juli 2024 (englisch).