Rotifera
| Règne | Animalia |
|---|---|
| Sous-règne | Bilateria |
| Infra-règne | Protostomia |
| Super-embr. | Platyzoa |
Classes de rang inférieur
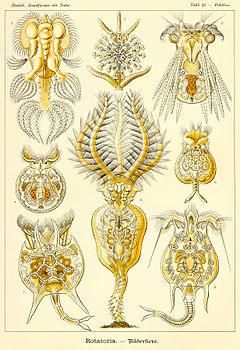
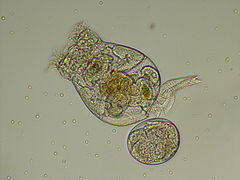
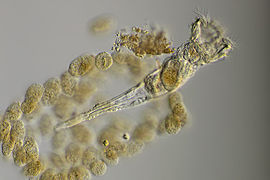
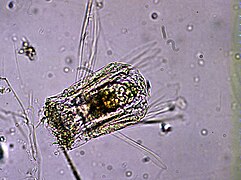
Les Rotifères (Rotifera) constituent un embranchement du règne animal. Ce sont de petits organismes bilatériens (i.e. triploblastiques) protostomiens syndermés mesurant entre 50 µm et 3 mm qui ont souvent une forme de trompette, cylindrique ou sphérique. Ils possèdent deux couronnes de cils autour de leur bouche ainsi qu'un système organique spécialisé avec notamment un tube digestif[1].
On sait désormais que l'embranchement des Acanthocephala est en fait un groupe de Rotifères devenus parasites[2]. La notion actuelle de Rotifère (s.l.) est donc élargie aux Acanthocéphales et devient ainsi identique au clade des Syndermata[3]. Avec les Micrognathozoa et les Gnathostomulida ils appartiennent au clade des Gnathifera (au sein duquel ils sont groupe frère avec les Micrognathozoa), partageant avec eux la présence de mâchoires organisées de manière similaire[4],[5],[6].
Description
[modifier | modifier le code]

Ces Pseudocœlomates ont un corps en trois parties bien distinctes: la tête (appareil rotateur) le tronc et le pied terminé par deux orteils. La tête et la partie postérieure ne sont pas couvertes par la cuticule[7],[8].
Le terme Rotifère (du latin rota, « roue ») leur vient des deux couronnes de cils entourant leur bouche, dans la région antérieure, qui tourbillonnent en sens contraire pour faire entrer l'eau et les particules de nourriture qui l'accompagnent. Ces cils peuvent aussi servir à la locomotion chez certaines espèces. Au fond du pharynx musculeux se situe un appareil masticateur caractéristique, le mastax, constitué de sept pièces dures et mobiles servant à broyer la nourriture.
Postérieur, leur pied possède souvent une glande adhésive qui permet à certaines espèces de se fixer au substrat. L'anus est en position postérieure et le système excréteur est formé de deux protonéphridies à l'intérieur du pseudocœlome. Le pseudocœlome renferme les organes internes. Cette cavité corporelle est en partie tapissée de mésoderme. Le liquide du pseudocœlome sert de squelette hydraulique, ce sont les mouvements de l'organisme qui assurent la répartition du liquide dans tout le corps afin de permettre la diffusion des nutriments et des déchets.
Le système nerveux est formé d'un ganglion cérébral dorsal antérieur et d'un nombre variable de nerfs. Le système sensoriel est composé d'organes photorécepteurs rudimentaires et de cils. Il n'y a pas d'appareil respiratoire ou circulatoire et le dioxygène diffuse à travers les tissus. La paroi du corps comporte une cuticule souple, la lorica[9]. L'animal est souvent transparent mais sa couleur peut être verte, orange, rouge ou brune selon la nourriture ingérée.
Reproduction
[modifier | modifier le code]La plupart du temps, les rotifères ont une multiplication asexuée. Mais ils peuvent aussi se multiplier de manière sexuée, notamment quand leurs conditions de vie se dégradent.
Certaines espèces produisent deux sortes d'œufs, la première sorte donne des femelles et la seconde donne des mâles simplifiés incapables de se nourrir. Ces mâles produisent cependant des spermatozoïdes qui iront féconder les ovules femelles.
Les zygotes ont la particularité de pouvoir survivre même si leur milieu de vie s'assèche. Lorsque les conditions redeviennent plus favorables, ils sortent de leur léthargie et deviennent de nouvelles femelles qui se reproduisent par parthénogenèse.
Il semble qu'au sein des rotifères, toute la classe des Bdelloïdés se reproduit par parthénogenèse depuis plus de 35 millions d'années, sans qu'aucune trace de l'existence de mâle (ni même de méiose) n'ait à ce jour été découverte. Leur triple capacité de parthénogenèse, de capacité à protéger et réparer leur ADN et de résistance à la dessiccation pourrait constituer un avantage compétitif décisif dans le milieu soumis à de régulières dessiccations[10].
Dans les années 2000, plusieurs anomalies ou curiosités génétiques avaient été repérées chez ces Bdelloïdés[11], mais on ne comprenait pas encore comment ces espèces avaient pu se passer de sexualité depuis aussi longtemps, avant qu'en une étude publiée dans la revue Nature apporte de premières explications[12]. Les chercheurs ont réussi à séquencer le génome d’Adineta vaga et ont montré qu'il n'existe pas dans cette espèce de similarités structurales complètes entre les deux chromosomes de chaque paire. Un chromosome donné peut même porter les deux versions d'un même gène[13].
L'espèce de rotifère A. vaga est connue pour être particulièrement résistante ; elle est capable d'anhydrobiose, avec une tolérance exceptionnelle à la dessiccation[14], mais aussi de réparer son ADN y compris après une forte irradiation (capacité supérieure à celles de Deinococcus radiodurans[15]). Récemment, une étude a confirmé que lors de périodes de sécheresse la dessiccation entraînait l'accumulation de cassures double brin d'ADN dans le génome d'A. vaga. Malgré l'accumulation d'un nombre important de ces cassures, ces individus sont capables de se réhydrater, survivre et réparer complètement leurs génomes[16].
Elle intriguait les scientifiques, car, selon les observations biologiques et paléontologiques disponibles, elle ne se reproduit qu’asexuellement, par parthénogenèse thélytoque, et ce depuis des millions d'années ; ce qui défie les lois de la sélection naturelle. On n'a jamais observé que des femelles de cette espèce pourtant assez courante. Sa survie en l'absence de mâle est une caractéristique insolite dans le monde animal ; la plupart des animaux (et des végétaux) se reproduisent en effet par voie sexuée au moins périodiquement, ce qui permet la diversification génétique, évite l'accumulation de mutations nuisibles dans leur génome, et assure à ces espèces une pérennisation réputée bien meilleure que celle des animaux asexués.
Pour tenter de comprendre ce phénomène, un consortium international (codirigé par le CEA-Genoscope et l’Université de Namur, avec le CNRS (France) et l'INRA (France)[17]) a analysé son génome.
Les résultats publiés mi-2013 confirment l'asexualité de cette espèce (son génome présente une structure incompatible avec la reproduction sexuée, il dispose de chromosomes homologues, mais les gènes y sont disposés dans des ordres différents, et parfois même sur un seul chromosome, ce qui empêcherait en cas de reproduction sexuée la production normale de gamètes).
Cette étude a aussi expliqué la survie de l'espèce : le génome d’A. vaga dispose de mécanismes contournant les effets négatifs d'une longue période de reproduction asexuée[18] : il opère de fréquentes « conversions géniques » à l'intérieur de son génome, via une sorte de « copier-coller » de gènes, un mécanisme qui pourrait selon les auteurs de l'étude atténuer voire supprimer l'accumulation de mutations délétères. Grâce à cette étude, la science dispose maintenant d'un nouvel « indice génétique » pour détecter d'éventuelles autres espèces animales capables d'aussi durablement se reproduire sans mâle. Ces conversions géniques pourraient avoir lieu lorsque A. vaga répare son génome après dessiccation. Par ce même mécanisme il lui serait possible de capturer des gènes en provenance d'autres organismes [Comment ?] comme l'ont prouvé les données récentes du séquençage d'A. vaga[18],[16].
Un rotifère bdelloïde est revenu à la vie après avoir été congelé pendant 24 000 ans en Sibérie. Il est ensuite parvenu à se cloner, ont annoncé lundi 7 juin 2021 des scientifiques russes. L'animal était en cryptobiose : un état dans lequel le métabolisme est presque complètement à l'arrêt. Son âge est estimé entre 23 960 et 24 485 ans. Stas Malavin qui a séquencé son génome indique que celui-ci est proche d'Adineta vaga, il s'agirait d'une nouvelle espèce. Une fois décongelé, l'animal a pu se reproduire seul par parthénogenèse[19].
Écologie
[modifier | modifier le code]Ils vivent principalement en eau douce mais quelques espèces occupent les eaux salées ainsi que les milieux humides. Ils se nourrissent essentiellement de microorganismes en suspension dans l'eau[20]. Certains Rotifères sont des parasites de crustacés, de mollusques et d'annélides. Ils composent une grande partie du zooplancton d'eau douce et constituent une source de nourriture importante dans les écosystèmes d'eau douce. En milieu terrestre, ils interviennent dans la décomposition des matières organiques dans le sol. Ils sont utilisés dans des études écotoxicologiques[21].
Aquaculture et aquariophilie
[modifier | modifier le code]Certaines espèces de rotifères comme Brachionus plicatilis sont utilisées en aquaculture et aquariophilie pour l'élevage des larves de poisson[22]. Elles constituent souvent la première nourriture distribuée aux larves avant les artemias.
La culture des rotifères se fait dans des cuves munies d'une bonne aération (diffuseur d'air ou d'oxygène) et la nourriture est constituée d'algues (Nannochloris, Isochrisis...), de levure de boulanger ou d'autres produits spécifiques à la culture ou l'enrichissement des rotifères.
Pour une culture destinée à l'aquarium récifal, un nourrissage avec du phytoplancton vivant sera préférable à la levure de boulanger, notamment au niveau des acides gras essentiels contenu dans le phytoplancton et pour éviter de rajouter en grande quantité des phosphates ( Po4 ).
Place dans le monde vivant
[modifier | modifier le code]L'embranchement des Rotifères contient 4 classes, environ 33 familles, 112 genres pour 1816 espèces. Le plus ancien fossile connu, appartenant à Keratella sp, a été découvert à la base de l'Éocène moyen d'Australie et remonte à −45 Ma [23].
Systématique
[modifier | modifier le code]|
Les Rotifères se décomposent en :
et désormais :
|
Selon World Register of Marine Species (7 mars 2016)[25] :
|
La position exacte des Rotifères parmi les Lophotrochozoaire n'est pas résolue, mais on les place fréquemment dans le groupe des Gnathifères et eux-mêmes parmi les Platyzoaires.
-
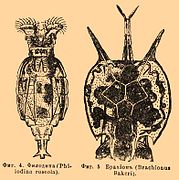
Philodina sp., un Philodinidae
-
-
Polyarthra sp., un Synchaetidae
Voir aussi
[modifier | modifier le code]Bibliographie
[modifier | modifier le code]- Biologie 7e édition, Neil Campbell & Jane Reece, 2007.
- Classification phylogénétique du vivant 3e édition, Guillaume Lecointre & Hervé Le Guyader, éd. Belin, 2001, (ISBN 2-7011-4273-3)
Références taxinomiques
[modifier | modifier le code]- (en) Référence WoRMS : Rotifera Cuvier, 1817 (+ liste classes + liste ordres)
- (fr + en) Référence ITIS : Rotifera Cuvier, 1817
- (en) Référence Tree of Life Web Project : Rotifera
- (en) Référence Animal Diversity Web : Rotifera
- (en) Référence Catalogue of Life : Rotifera (consulté le )
- (en) Référence Fauna Europaea : Rotifera (consulté le )
- (en) Référence NCBI : Rotifera (taxons inclus)
Liens externes
[modifier | modifier le code]Notes et références
[modifier | modifier le code]- Roger pourriot (auteur du chapitre), Jean-René Durand (éditeur) et Christian Lévèque (éditeur), ORSTOM, Rotifères, In: "Flore et faune aquatiques de l'Afrique sahélo-soudanienne : tome 1 ", Paris, , 389 p. (ISBN 2-7099-0521-1 (édité erroné), lire en ligne), chap. 6 (« Rotifères »), p. 219-244
- James R. Garey et al. 1996. Molecular evidence for Acanthocephala as a subtaxon of Rotifera
- (en) Diego Fontaneto, « Molecular phylogenies as a tool to understand diversity in rotifers », International Review of Hydrobiology, vol. 99, , p. 178–187 (ISSN 1522-2632, DOI 10.1002/iroh.201301719, lire en ligne, consulté le )
- Guillaume Lecointre et Hervé Le Guyader, Classification phylogénétique du vivant. Tome 2, Paris, Belin, 831 p. (ISBN 978-2-410-00385-7 et 2410003850, OCLC 987914329, lire en ligne)
- (en) Richard C. Brusa, Wendy Moore et Stephen M. Shuster, Invertebrates, Sunderland (Mass.), Sinauer Associates is an imprint of Oxford University Press, , 1104 p. (ISBN 978-1-60535-375-3, lire en ligne)
- Reinhard M. Rieger et Seth Tyler, « Sister-Group Relationship of Gnathostomulida and Rotifera-Acanthocephala », Invertebrate Biology, vol. 114, no 2, , p. 186–188 (DOI 10.2307/3226891, lire en ligne, consulté le )
- Roger Pourriot et A. J. Francez, « Introduction pratique à la Systématique des Organismes des Eaux continentales françaises - 8 - Rotifères », Bulletin Mensuel de la Societé Linnéenne de Lyon, vol. 55, no 8, , p. 148-176 (lire en ligne)
- Jerzy Wiszniewski, « Les rotifères psammiques », Annales musei zoologici Polonici, Varsovie, vol. 10, no 19, , p. 339-405 (lire en ligne)
- Paul de Beauchamp, Rotifères, Encyclopædia Universalis en ligne, 3 p. (lire en ligne), p. 1
- Florian Maderspacher (2008), Sex and the drought, Current Biology, volume 18, numéro 21, 11 novembre 2008, pages R983-R985
- Eugene A. Gladyshev, Matthew Meselson, Irina R. Arkhipova (2007), A deep-branching clade of retrovirus-like retrotransposons in bdelloid rotifers ; Gene volume 390, numéros 1–2, 1er avril 2007, pages 136–145 ASILOMAR
- Genomic Evidence for Ameiotic evolution in the Bdelloid rotifer Adineta vaga, Jean-François Flot et al., Nature 2013
- Voir les explications plus détaillées dans cet article du Monde
- Horst Feldmann, Jens Lapinski, Alan Tunnacliffe (2003), Anhydrobiosis without trehalose in bdelloid rotifers ; FEBS Letters, vol. 553, no 3, 2003-10-23, pages 387–390
- E. Gladyshev, M. Meselson (2008), Extreme resistance of bdelloid rotifers to ionizing radiation ; Proc. Natl. Acad. Sci. U.S.A., 105, p. 5139–5144
- Hespeels, B., Knapen, M., Hanot-Mambres, D., Heuskin, A.-C., Pineux, F., Lucas, S., Koszul, R., et Van Doninck, K. (2014), Gateway to genetic exchange? DNA double-strand breaks in the bdelloid rotifer Adineta vaga submitted to desiccation. Journal of Evolutionary Biology. doi: 10.1111/jeb.12326
- www.science.gouv.fr (2013), Génomique : un animal à la reproduction asexuée livre ses mystères ; 24 juillet 2013, consulté 2013-08-28
- Jean-François Flot et al. (2013), « Genomic evidence for ameiotic evolution in the bdelloid rotifer Adineta vaga », Nature, DOI:10.1038/nature12326
- Fabien Goubet, avec ATS, « Hibernatus? Un animal survit 24 000 ans dans le permafrost », Le Temps, (lire en ligne)
- (en) Elizabeth J. Walsh, Hilary A. Smith et Robert L. Wallace, « Rotifers of temporary waters », International Review of Hydrobiology, vol. 99, , p. 3–19 (ISSN 1522-2632, DOI 10.1002/iroh.201301700, lire en ligne, consulté le )
- (en) Terry W. Snell et Célia Joaquim-Justo, « Workshop on rotifers in ecotoxicology », Hydrobiologia, vol. 593, , p. 227–232 (ISSN 0018-8158 et 1573-5117, DOI 10.1007/s10750-007-9045-x, lire en ligne, consulté le )
- (en) Esther Lubzens, Odi Zmora et Yoav Barr, « Biotechnology and aquaculture of rotifers », Hydrobiologia, vol. 446-447, , p. 337–353 (ISSN 0018-8158 et 1573-5117, DOI 10.1023/A:1017563125103, lire en ligne, consulté le )
- Classification phylogénétique du vivant 3e édition, Guillaume Lecointre & Hervé Le Guyader, éd. Belin, 2001, (ISBN 2-7011-4273-3), p. 223
- Martín García-Varela, 2002. Phylogenetic analysis based on 18S ribosomal RNA gene sequences supports the existence of class polyacanthocephala (Acanthocephala).
- World Register of Marine Species, consulté le 7 mars 2016