An difríocht idir athruithe ar: "Ian poladamhach"
mNo edit summary |
mNo edit summary |
||
| Líne 48: | Líne 48: | ||
|} |
|} |
||
De réir mar a mhéadaíonn líon na n-adamh ocsaigine atá ceangailte le clóirín, éiríonn uimhir ocsaídiúcháin an chlóirín ní ba dheimhní. Is é an patrún coitianta seo a leanas is cúis leis seo; ar dtús, meastar gurb é an t-ian '''''-áit''''' ainm an bhuin; nuair a chuirtear sár- réimír leis cuireann sé ocsaigin leis, agus ag athrú an iarmhír ''-'''áit''''' go '''''-ít''''' laghdaítear líon na n-ocsaiginí faoi cheann amháin, gan an lucht a athrú. Leanann an patrún ainmniúcháin laistigh de go leor sraitheanna oxyanion éagsúla bunaithe ar fhréamh caighdeánach don tsraith áirithe sin. Tá ocsaigin amháin níos lú ag an g an '''''-ít''''' ná an '''''-áit''''', ach d'fhéadfadh go mbeadh uimhreacha difriúla d'adaimh ocsaigine ag '''''-áit'''''.Tá ceann amháin níos lú ocsaigine ag an ''-ít'' ná an '''''-áit'',''' ach d'fhéadfadh uimhreacha éagsúla adamh ocsaigine a bheith ag ainiain éagsúla '''''-áit'''''. |
De réir mar a mhéadaíonn líon na n-adamh ocsaigine atá ceangailte le clóirín, éiríonn uimhir ocsaídiúcháin an chlóirín ní ba dheimhní. Is é an patrún coitianta seo a leanas is cúis leis seo; ar dtús, meastar gurb é an t-ian '''''-áit''''' ainm an bhuin; nuair a chuirtear sár- réimír leis cuireann sé ocsaigin leis, agus ag athrú an iarmhír ''-'''áit''''' go '''''-ít''''' laghdaítear líon na n-ocsaiginí faoi cheann amháin, gan an lucht a athrú. Leanann an patrún ainmniúcháin laistigh de go leor sraitheanna oxyanion éagsúla bunaithe ar fhréamh caighdeánach don tsraith áirithe sin. Tá ocsaigin amháin níos lú ag an g an '''''-ít''''' ná an '''''-áit''''', ach d'fhéadfadh go mbeadh uimhreacha difriúla d'adaimh ocsaigine ag '''''-áit'''''.Tá ceann amháin níos lú ocsaigine ag an ''-ít'' ná an '''''-áit'',''' ach d'fhéadfadh uimhreacha éagsúla adamh ocsaigine a bheith ag ainiain éagsúla '''''-áit'''''. |
||
Ní oibríonn na rialacha seo le gach ainian poladamhach, ach baineann siad le roinnt de na cinn níos coitianta. Taispeánann an tábla seo a leanas an chaoi a n-úsáidtear na réimíreanna seo do chuid de na grúpaí ainian coitianta seo. |
|||
{| class="wikitable" |
|||
|- |
|||
| [[bróimíd]] |
|||
| [[hipeabróimít]] |
|||
| [[bróimít]] |
|||
| [[brómáit]] |
|||
| [[sárbhrómáit]] |
|||
|- |
|||
| Br<sup>-</sup> |
|||
| BrO<sup>-</sup> |
|||
| BrO<sub>2</sub><sup>-</sup> |
|||
| BrO<sub>3</sub><sup>-</sup> |
|||
| BrO<sub>4</sub><sup>-</sup> |
|||
|- |
|||
| [[iaidíd]] |
|||
| [[hipiaidít]] |
|||
| [[iaidít]] |
|||
| [[iadáit]] |
|||
| [[sár-iadáit]] |
|||
|- |
|||
| I<sup>-</sup> |
|||
| IO<sup>-</sup> |
|||
| IO<sub>2</sub><sup>-</sup> |
|||
| IO<sub>3</sub><sup>-</sup> |
|||
| IO<sub>4</sub><sup>-</sup> |
|||
|- |
|||
| [[suilfíd]] |
|||
| [[hipeashsuilfít]] |
|||
| [[suilfít]] |
|||
| [[sulfáit]] |
|||
| [[sárshulfáit]] |
|||
|- |
|||
| S<sub>2</sub><sup>-</sup> |
|||
| S<sub>2</sub>O<sub>2</sub><sup>2-</sup> |
|||
| SO<sub>3</sub><sup>2-</sup> |
|||
| SO<sub>4</sub><sup>2-</sup> |
|||
| SO<sub>5</sub><sup>2-</sup> |
|||
|- |
|||
| [[seiléiníd ]] |
|||
| [[hipisheiléiníd]] |
|||
| [[ion seiléinít|seiléinít]] |
|||
| [[seiléináit]] |
|||
| |
|||
|- |
|||
| Se<sub>2</sub><sup>-</sup> |
|||
| Se<sub>2</sub>O<sub>2</sub><sup>2-</sup> |
|||
| SeO<sub>3</sub><sup>2-</sup> |
|||
| SeO<sub>4</sub><sup>2-</sup> |
|||
| |
|||
|- |
|||
| [[Telluride (chemistry)|telluride]] |
|||
| [[hypotellurite]] |
|||
| [[tellurite (ion)|tellurite]] |
|||
| [[tellurate]] |
|||
| |
|||
|- |
|||
| Te<sub>2</sub><sup>-</sup> |
|||
| TeO<sub>2</sub>O<sub>2</sub><sup>2-</sup> |
|||
| TeO<sub>3</sub><sup>2-</sup> |
|||
| TeO<sub>4</sub><sup>2-</sup> |
|||
| |
|||
|- |
|||
| [[nitride]] |
|||
| [[hyponitrite]] |
|||
| [[nitrite]] |
|||
| [[nitrate]] |
|||
| [[peroxynitrate|pernitrate]] |
|||
|- |
|||
| N<sup>3-</sup> |
|||
| N<sub>2</sub>O<sub>2</sub><sup>2-</sup> |
|||
| NO<sub>2</sub><sup>-</sup> |
|||
| NO<sub>3</sub><sup>-</sup> |
|||
| NO<sub>4</sub><sup>-</sup> |
|||
|- |
|||
| [[phosphide]] |
|||
| [[hypophosphite]] |
|||
| [[phosphite]] |
|||
| [[phosphate]] |
|||
| [[perphosphate]] |
|||
|- |
|||
| {{chem|P|3-}} |
|||
| {{chem|H|2|PO|2|-}} |
|||
| {{chem|PO|3|3-}} |
|||
| {{chem|PO|4|3-}} |
|||
| {{chem|PO|5|3-}} |
|||
|- |
|||
| [[arsenide]] |
|||
| [[hypoarsenite]] |
|||
| [[arsenite]] |
|||
| [[arsenate]] |
|||
| |
|||
|- |
|||
| {{chem|As|3-}} |
|||
| {{chem|AsO|2|3-}} |
|||
| {{chem|AsO|3|3-}} |
|||
| {{chem|AsO|4|3-}} |
|||
| |
|||
|- |
|||
|} |
|||
Is féidir le roinnt ocsainian démhéiriú le caillteanas adamh ocsaigine. Úsáidtear an réimír ''pirea-'' srl.<ref>[https://www.tearma.ie/q/pyro-/ pyro-]</ref>, mar is minic a bhíonn téamh i gceist leis an imoibriú a chruthaíonn na cineálacha ceimiceáin seo chun na cineálacha struchtúr seo a chruthú.<ref>{{GoldBookRef|file=P04959|title=pyro}}</ref> Tá an an réimír ''pirea-'' léirithe freisin ag an réimír ''dé-''. Mar shampla, is dimer é ian déchrómáite. |
|||
{|class=wikitable |
|||
| [[sulfite]] |
|||
| [[pyrosulfite]] |
|||
|- |
|||
| {{chem|S|O|3|2-}} |
|||
| {{chem|S|2|O|5|2-}} |
|||
|- |
|||
| [[sulfate]] |
|||
| [[pyrosulfate]] |
|||
|- |
|||
| {{chem|S|O|4|2-}} |
|||
| {{chem|S|2|O|7|2-}} |
|||
|- |
|||
| [[phosphite anion|phosphite]] |
|||
| [[pyrophosphite]] |
|||
|- |
|||
| {{chem|P|O|3|3-}} |
|||
| {{chem|P|2|O|5|4-}} |
|||
|- |
|||
| [[phosphate]] |
|||
| [[pyrophosphate]] |
|||
|- |
|||
| {{chem|P|O|4|3-}} |
|||
| {{chem|P|2|O|7|4-}} |
|||
|- |
|||
| [[arsenate]] |
|||
| [[pyroarsenate]] |
|||
|- |
|||
| {{chem|As|O|4|3-}} |
|||
| {{chem|As|2|O|7|4-}} |
|||
|- |
|||
| [[Chromate and dichromate|chromate]] |
|||
| [[dichromate]] |
|||
|- |
|||
| {{chem|CrO|4|2-}} |
|||
| {{chem|Cr|2|O|7|2-}} |
|||
|- |
|||
| [[carbonate]] |
|||
| [[dicarbonate]] |
|||
|- |
|||
| {{chem|CO|3|2-}} |
|||
| {{chem|C|2|O|5|2-}} |
|||
|} |
|||
== Tagairtí == |
== Tagairtí == |
||
Leagan ó 17:07, 4 Iúil 2024

Is éard is ian poladamhach (ar a dtugtar freisin ian iladamhach nó ian móilíneach) ann ná ian a cruthaíodh trí leictreon amháin nó níos mó a bhaint (iain dheimhneacha) as móilín nó a chur leis (iain dhiúltacha) gan an struchtúr móilíneach a scoilt. Freagraíonn mais an iain seo do shuim mhaiseanna na n-iseatóp is flúirsí a tharlaíonn go nádúrtha de na hadaimh éagsúla a chuimsíonn an móilín (le ceartúchán do mhaiseanna an leictreoin/na leictreon a chailltear nó a fhaightear). Mar shampla, beidh mais an iain mhóilíneach de bhróimeatán C2H5Br cothrom le 2×12 móide 5×1.0078246 móide 78.91839 lúide mais an leictreoin (me). Tá sé seo cothrom le 107.95751 u−me, arb é u an t-aonad maise adamhaí aontaithe, atá bunaithe ar an gcaighdeán go bhfuil mais an iseatóip12C = 12 u go beacht.[1]
I dtéarmaí eile, is éard atá ann ná sraith de dhá adamh nó níos mó nasctha go comhfhiúsach, nó coimpléasc miotail, ar féidir a mheas mar aonad amháin agus a bhfuil lucht glan aige nach bhfuil ina nialas. Murab ionann agus móilín, a bhfuil lucht glan de nialas aige, is ian é an speiceas ceimiceach seo. Tá an bhrí "a lán" ag an réimír pola- sa Ghréigis, ach is minic a chuirtear síos ar iain de dhá adamh mar poladamhach nó iladamhach.[2]
Sa litríocht níos sine, féadfar tagairt a dhéanamh d'ian poladamhach ina ionad sin mar fhréamh (nó go hannamh, mar ghrúpa fréimhe). In úsáid chomhaimseartha, tagraíonn an téarma fréamh do shaorfhréamhacha éagsúla, ar speicis iad a bhfuil leictreon neamhphéireáilte acu agus nach gá iad a bheith lucthaithe.
Ainmníocht na n-ainian poladamhach
Tá roinnt patrún ann ar féidir a úsáid chun ainmníocht na n-ainian poladamhach a fhoghlaim. Ar an gcéad dul síos, nuair a chuirtear an réimír dé le hainm, cuirtear hidrigin le foirmle an iain agus méadaítear a lucht faoi 1, agus an dara ceann mar iarmhairt ar lucht +1 an iain hidrigine. Rogha eile ar an réimír dé- is ea an focal hidrigin a úsáid ina háit: an t-ainian a dhíorthaítear ó H++. Mar shampla, lig dúinn smaoineamh ar ian carbónáite (CO32-).
Tugtar décharbónáit nó hidrigincharbónáit air. Tugtar prótónáitiú ar an bpróiseas seo.
Ocsainiain is ea an chuid is mó de na hainiain pholadamhacha choitianta, bunanna comhchuingeacha d'ocsaigéid (aigéid a dhíorthaítear ó ocsaídí na ndúl neamhmhiotalach). Mar shampla, an t-ainian sulfáite, SO42-) díorthaithe ó H2SO4, ar féidir é a mheas mar SO3 + H2O.
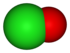
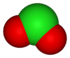
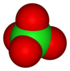
Tá an dara riail bunaithe ar staid ocsaídiúcháin an adaimh lárnaigh san ian, a bhaineann go minic (ach ní i gcónaí) go díreach le líon na n-adamh ocsaigine san ian, ag leanúint an phatrúin a thaispeántar thíos. Taispeánann an tábla seo a leanas an fhine ocsainiain chlóirín:
| Staid ocsaídiúcháin | −1 | +1 | +3 | +5 | +7 |
|---|---|---|---|---|---|
| Ainm an ainiain | clóiríd | hipeaclóirít | clóirít | clóráit | sárchlóráit |
| Foirmle | Cl- | ClO- | ClO2- | ClO3- | ClO4- |
| Sstruchtúr | 
|
|
|

|
|
De réir mar a mhéadaíonn líon na n-adamh ocsaigine atá ceangailte le clóirín, éiríonn uimhir ocsaídiúcháin an chlóirín ní ba dheimhní. Is é an patrún coitianta seo a leanas is cúis leis seo; ar dtús, meastar gurb é an t-ian -áit ainm an bhuin; nuair a chuirtear sár- réimír leis cuireann sé ocsaigin leis, agus ag athrú an iarmhír -áit go -ít laghdaítear líon na n-ocsaiginí faoi cheann amháin, gan an lucht a athrú. Leanann an patrún ainmniúcháin laistigh de go leor sraitheanna oxyanion éagsúla bunaithe ar fhréamh caighdeánach don tsraith áirithe sin. Tá ocsaigin amháin níos lú ag an g an -ít ná an -áit, ach d'fhéadfadh go mbeadh uimhreacha difriúla d'adaimh ocsaigine ag -áit.Tá ceann amháin níos lú ocsaigine ag an -ít ná an -áit, ach d'fhéadfadh uimhreacha éagsúla adamh ocsaigine a bheith ag ainiain éagsúla -áit.
Ní oibríonn na rialacha seo le gach ainian poladamhach, ach baineann siad le roinnt de na cinn níos coitianta. Taispeánann an tábla seo a leanas an chaoi a n-úsáidtear na réimíreanna seo do chuid de na grúpaí ainian coitianta seo.
| bróimíd | hipeabróimít | bróimít | brómáit | sárbhrómáit |
| Br- | BrO- | BrO2- | BrO3- | BrO4- |
| iaidíd | hipiaidít | iaidít | iadáit | sár-iadáit |
| I- | IO- | IO2- | IO3- | IO4- |
| suilfíd | hipeashsuilfít | suilfít | sulfáit | sárshulfáit |
| S2- | S2O22- | SO32- | SO42- | SO52- |
| seiléiníd | hipisheiléiníd | seiléinít | seiléináit | |
| Se2- | Se2O22- | SeO32- | SeO42- | |
| telluride | hypotellurite | tellurite | tellurate | |
| Te2- | TeO2O22- | TeO32- | TeO42- | |
| nitride | hyponitrite | nitrite | nitrate | pernitrate |
| N3- | N2O22- | NO2- | NO3- | NO4- |
| phosphide | hypophosphite | phosphite | phosphate | perphosphate |
| Teimpléad:Chem | Teimpléad:Chem | Teimpléad:Chem | Teimpléad:Chem | Teimpléad:Chem |
| arsenide | hypoarsenite | arsenite | arsenate | |
| Teimpléad:Chem | Teimpléad:Chem | Teimpléad:Chem | Teimpléad:Chem |
Is féidir le roinnt ocsainian démhéiriú le caillteanas adamh ocsaigine. Úsáidtear an réimír pirea- srl.[3], mar is minic a bhíonn téamh i gceist leis an imoibriú a chruthaíonn na cineálacha ceimiceáin seo chun na cineálacha struchtúr seo a chruthú.[4] Tá an an réimír pirea- léirithe freisin ag an réimír dé-. Mar shampla, is dimer é ian déchrómáite.
Tagairtí
- ↑ https://goldbook.iupac.org/terms/view/M03988 Gold Book
- ↑ Ionic Compounds Containing Polyatomic Ions. [1]
- ↑ pyro-
- ↑ Teimpléad:GoldBookRef
