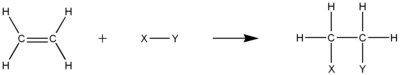Alqueno

En química orgánica, un alqueno é un hidrocarburo insaturado que contén polo menos un dobre enlace carbono–carbono.[1] Os termos alqueno e olefina úsanse xeralmente como sinónimos (ver a sección de máis abaixo de Nomenclatura). Os alquenos acíclicos, con só un dobre enlace e ningún outro grupo funcional, coñecidos como monoenos, forman unha serie homóloga de hidrocarburos coa fórmula xeral CnH2n.[2] Os alquenos teñen dous átomos de hidróxeno menos que os alcanos correspondentes (co mesmo número de átomos de carbono) e dous máis que os alquinos. O alqueno máis simple é o etileno (C2H4), chamado eteno na nomenclatura da IUPAC, que é o composto orgánico producido a maior escala industrialmente.[3] Os compostos aromáticos debúxanse a miúdo como alquenos cíclicos, pero as súas estruturas e propiedades son diferentes e non se considera que sexan alquenos.[2]
Estrutura
[editar | editar a fonte]Enlaces
[editar | editar a fonte]
Igual que os enlaces covalentes simples, os enlaces dobres poden describirse como solapamentos de orbitais atómicos, coa diferenza que o enlace simple consiste nun só enlace sigma, e un enlace dobre carbono-carbono consta dun enlace sigma e un enlace pi. Este dobre enlace é máis forte que o simple (611 kJ/mol para o C=C fronte a 347 kJ/mol para o C–C)[1] e tamén máis curto, cunha lonxitude de enlace media de 1,33 ángstroms (133 pm).
Cada carbono do dobre enlace utiliza os seus tres orbitais híbridos sp2 para formar enlaces sigma con tres átomos (o outro carbono e dous átomos de hidróxeno). Os orbitais atómicos 2p non hibridados, que son perpendiculares ao plano creado polos eixes dos tres orbitais híbridos sp², combínanse para formar o enlace pi. Este enlace está fóra do eixe C–C principal, cunha metade do enlace a un lado da molécula e a outra metade no outro.
A rotación no dobe enlace carbono–carbono está estrinxida porque romper o aliñamento dos orbitais p dos dous átomos de carbono ten un custo enerxético. Como consecuencia, os alquenos substituídos poden existir como dous isómeros, chamados cis ou trans. Os alquenos máis complexos poden nomearse coa notación E–Z para moléculas con tres ou catro substituíntes distintos (grupos laterais). Por exemplo, dos isómeros do buteno, os dous grupos metilo do (Z)-but-2-eno (tamén chamado cis-2-buteno) aparecen no mesmo lado do dobre enlace, e no (E)-but-2-eno (tamén chamado trans-2-buteno) os grupos metilo están situados en lados opostos. Estes dous isómeros do buteno son lixeiramente diferentes nas súas propiedades químicas e físicas.
Un xiro de 90° do enlace C=C (que pode ser determinado polas posicións dos grupos unidos aos carbonos) require menos enerxía que a forza que ten un enlace pi, e o enlace pode resistilo. Isto contradí unha afirmación común en libros de texto de que os orbitais pi non poderían soportar ese tipo de enlace. O certo é que a mala aliñación dos orbitais p é menor da esperada porque ten lugar a piramidalización (alqueno piramidal). O trans-cicloocteno é un alqueno tensionado estable e o mal aliñamento do orbital é de só 19° cun ángulo diedro de 137° (normal 120°) e un grao de piramidalización de 18°.[4] O isómero trans do ciclohepteno só é estable a baixas temperaturas.
Forma
[editar | editar a fonte]Como predixo o modelo VSEPR da repulsión de pares de electróns, a xeometría molecular dos alquenos inclúe ángulos de enlace de cada carbono dun enlace dobre duns 120°. O ángulo pode variar debido á tensión estérica introducida por interaccións non enlazadas entre grupos funcionais unidos aos carbonos do dobre enlace. Por exemplo, o ángulo de enlace C–C–C no propileno é de 123,9°.
Para alquenos ponteados, a regra de Bredt establece que un dobre enlace non pode aparecer na cabeza de ponte dun sistema de aneis ponteado a non ser que os aneis sexan o suficientemente grandes.[5] Segundo Fawcett e definindo S como o número total de átomos non cabeza de ponte nos aneis,[6] os sistemas bicíclicos requiren S ≥ 7 para a estabilidade[5] e os sistemas tricíclicos requiren S ≥ 11.[7]
Propiedades físicas
[editar | editar a fonte]As propiedades físicas dos alquenos e alcanos son similares. Son incoloros, non polares, combustibles e case inodoros. O estado físico depende da masa molecular: igual que os correspondentes hidrocarburos saturados, os alquenos máis simples, eteno, propeno e buteno son gases a temperatura moderada. Os alquenos lineares de aproximadamente cinco a dezaseis carbonos son líquidos e os alquenos maiores son sólidos cerosos.
Reaccións
[editar | editar a fonte]Os alquenos son compostos relativamente estables, pero son máis reactivos que os alcanos, debido á reactividade do enlace pi carbono-carbono ou á presenza de centros CH alílicos. A maioría das reaccións dos alquenos implican adicións a este enlace pi, formando novos enlaces sigma. Os alquenos serven como materia prima para a industria petroquímica porque poden participar nunha gran variedade de reaccións, especialmente a polimerización e a alquilación.
Reaccións de adición
[editar | editar a fonte]Os alquenos reaccionan en moitas reaccións de adición, que se producen pola apertura do dobre enlace. A maioría destas reaccións de adición seguen o mecanismo de adición electrofílica. Exemplos son a hidrohaloxenación, haloxenación, formación de halohidrina, oximercuración, hidroboración, adición de diclorocarbeno, reacción de Simmons-Smith, hidroxenación catalítica, epoxidación, polimerización de radicais e hidroxilación.
Hidroxenación
[editar | editar a fonte]A hidroxenación de alquenos produce os correspondentes alcanos. A reacción é levada a cabo baixo presión a temperaturas de 200 °C en presenza dun catalizador metálico. Os catalizadores industriais comúns están baseados no platino, níquel ou paladio. Para a síntese de laboratorio emprégase con frecuencia o níquel de Raney (unha aliaxe de níquel e aluminio). O exemplo máis simple desta reacción é a hidroxenación catalítica de etileno para render etano:
- CH2=CH2 + H2 → CH3–CH3
Hidratación
[editar | editar a fonte]A reacción de hidratación, a adición de auga ao dobre enlace dos alquenos, rende alcohois. A reacción está catalizada por ácidos fortes como o ácido sulfúrico. Esta reacción realízase a escala industrial para producir etanol.
- CH2=CH2 + H2O → CH3–CH2OH
Os alquenos poden tamén converterse en alcohois por medio da reacción de oximercuración–desmercuración, a reacción de hidroboración–oxidación ou pola hidratación de Mukaiyama.
Haloxenación
[editar | editar a fonte]Na haloxenación electrofílica a adición de bromo ou cloro elementais a alquenos rende dibromo- e dicloroalquenos (1,2-dihaluros ou etileno dihaluros) veciñais, respectivamente. A decoloración dunha solución de bromo en auga é unha proba analítica para a presenza de alquenos:
- CH2=CH2 + Br2 → BrCH2–CH2Br
As reaccións relacionadas tamén se usan como medidas cuantitativas de insaturación, expresadas como o número de bromo e o número de iodo dun composto ou mestura.
Hidrohaloxenación
[editar | editar a fonte]A hidrohaloxenación é a adición de haluros de hidróxeno como o HCl ou o HI a alquenos para render os correspondentes haloalcanos:
- CH3–CH=CH2 + HI → CH3–CHI-CH2–H
Se os dous átomos de carbono no dobre enlace están ligados a un diferente número de átomos de hidróxeno o halóxeno encóntrase preferencialmente no carbono con menos substituíntes de hidróxeno. Estes padróns coñécense como regra de Markovnikov. O uso de iniciadores radicais ou outros compostos poden levar a formar o produto oposto. O ácido hidrobrómico tende especialmente a formar radicais en presenza de varias impurezas ou mesmo de oxíxeno atmosférico, orixinando un resultado inverso ao da regra de Markovnikov:[8]
- CH3–CH=CH2 + HBr → CH3–CHH–CH2–Br
Formación de halohidrina
[editar | editar a fonte]Os alquenos reaccionan con auga e halóxenos para formar halohidrinas por unha reacción de adición. Prodúcese a rexioquímica de Markovnikov e a antiestereoquímica.
- CH2=CH2 + X2 + H2O → XCH2–CH2OH + HX
Oxidación
[editar | editar a fonte]Os alquenos son oxidados cun gran número de axenes oxidantes. En presenza de oxíxeno, os alquenos arden cunha labarada brillante, producindo dióxido de carbono e auga. A oxidación catalítica con oxíxeno ou a reacción con ácidos percarboxílicos dá lugar a epóxidos. A reacción con ozono na ozonólise causa a rotura do dobre enlace, rendendo dous aldehidos ou cetonas. A reacción con KMnO4 quente concentrado (ou outros sales oxidantes) nunha solución ácida renderá cetonas ou ácidos carboxílicos.
- R1–CH=CH–R2 + O3 → R1–CHO + R2–CHO + H2O
Este reacción pode utilizarse para determinar a posición dun enlace dobre nun alqueno descoñecido.
A oxidación pode pararse no diol veciñal en vez de que se produza unha clivaxe completa do alqueno usando KMnO4 en condicións suaves (diluído, a temperatura máis baixa) ou con tetróxido de osmio ou outros oxidantes.
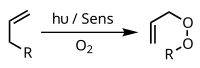
Fotooxixenación
[editar | editar a fonte]En presenza dun fotosensibilizador apropiado, como o azul de metileno e luz, os alquenos poden sufrir reaccións cunha especie reactiva do oxíxeno xerada polo fotosensibilizador, como un radical hidroxilo, oxíxeno singlete ou ión superóxido. Estes fotoquímicos reactivos intermediarios xéranse en varios tipos de procesos alternativos e reaccións, que poden ser controladas elixindo as condicións específicas de reacción, orixinando unha ampla variedade de produtos. Un exemplo común é a cicloadición [4+2] de oxíxeno singlete cun dieno como o ciclopentadieno para render un endoperóxido:
![Xeración dun oxíxeno singlete e a súa cicloadición [4+2] con ciclopentadieno](http://178.128.105.246/cars-http-upload.wikimedia.org/wikipedia/commons/thumb/1/12/4%2B2_cycloaddition_cyclopentadiene_O2.svg/350px-4%2B2_cycloaddition_cyclopentadiene_O2.svg.png)
Outro exemplo é a reacción eno de Schenck, na cal o oxíxeno singlete reacciona cunha estrutura alílica para dar un alil peróxido transposto:
Polimerización
[editar | editar a fonte]A polimerización de alquenos é unha reacción que rende polímeros de alto valor industrial con grande economía, como os plásticos polietileno e polipropileno. Os polímeros dos monómeros alquenos denomínanse en xeral poliolefinas ou en raros casos polialquenos. Un polímero formado a partir de alfa-olefinas denomínase polialfaolefina (PAO). A polimerización pode proceder por medio dun radical libre ou un mecanismo iónico, convertendo o dobre enlace nun enlace simple e formando enlaces simples para unirse a outros monómeros. A polimerización de dienos conxugados como o buta-1,3-dieno ou o isopreno (2-metilbuta-1,3-dieno) resulta principalmente na adición 1,4 e posiblemente algunha adición 1,2 do monómero dieno a unha cadea de polímero en crecemento.
Complexación de metais
[editar | editar a fonte]
Estrutura do bis(ciclooctadieno)niquel(0), un complexo metal–alqueno
Os alquenos son ligandos en complexos alqueno metal de transición. Os dous centros de carbono enlázanse co metal usando os orbitais pi* e pi C–C. As mono- e diolefinas utilízanse a miúdo como ligandos en complexos estables. O ciclooctadieno e norbornadieno son axentes quelantes moi usados, e incluso ás veces úsase o propio etileno como ligando, por exemplo, no sal de Zeise. Ademais, os complexos metal–alqueno son intermediarios en moitas reaccións catalizadas por metal como a hidroxenación, hidroformilación e polimerización.
Resumo das reaccións
[editar | editar a fonte]| Nome da reacción | Produto | Comentario |
|---|---|---|
| Hidroxenación | alcanos | adición do hidróxeno |
| Hidroalquenilación | alquenos | hidrometalación / inserción / beta-eliminación por catalizador metal |
| Reacción de adición de halóxeno | 1,2-dihaluro | adición electrofílica de halóxenos |
| Hidrohaloxenación (Markovnikov) | haloalcanos | adición de ácidos hidrohálicos |
| hidrohaloxenación anti-Markovnikov | haloalcanos | adición mediada por radicais libres de ácidos hidrohálicos |
| Hidroaminación | aminas | adición de enlaces N–H a dobres enlaces C–C |
| Hidroformilación | aldehidos | proceso industrial, adición de CO e H2 |
| Bishidroxilación de Sharpless | diois | oxidación, reactivo: tetróxido de osmio, ligando quiral |
| cis-hidroxilación de Woodward | diois | oxidación, reactivos: iodo, acetato de prata |
| Ozonólise | aldehidos ou cetonas | reactivo: ozono |
| Metátese de olefinas | alquenos | dous alquenos rearránxanse para formar dous novos alquenos |
| Reacción de Diels–Alder | ciclohexenos | cicloadición cun dieno |
| Reacción de Pauson–Khand | ciclopentenonas | cicloadición cun alqueno e CO |
| Hidroboración–oxidación | alcohois | reactivos: borano, despois un peróxido |
| Oximercuración-redución | alcohois | adición electrofílica de acetato mercúrico, despois redución |
| Reacción de Prins | 1,3-diois | adición electrofílica con aldehido ou cetona |
| Reacción de Paterno–Büchi | oxetanos | reacción fotoquímica cun aldehido ou cetona |
| Epoxidación | epóxido | adición electrofílica dun peróxido |
| Ciclopropanación | ciclopropanos | adición de carbenos ou carbenoides |
| Hidroacilación | cetonas | adición oxidativa / eliminación redutiva por catalizador metal |
| Hidrofosfinación | fosfinas | adición dun enlace fósforo-hidróxeno |
Síntese
[editar | editar a fonte]Métodos industriais
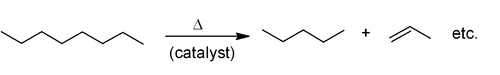
[editar | editar a fonte]Os alquenos prodúcense por cracking de hidrocarburos. As materias primas son principalmente compoñentes de condensado de gas natural (principalmente etano e propano) e nafta. Os alquenos rómpense a altas temperaturas, a miúdo en presenza de ceolita como catalizador, para producir unha mestura de alquenos principalmente alifáticos e alcanos de menor peso moleclar. A mestura é separada por destilación fraccionada. Isto úsase principalmente para a fabricación de alquenos pequenos (de ata seis carbonos).[9]
Relacionado con isto está a deshidroxenación catalítica, na que o alcano perde hidróxeno a alta temoperatura para producir o alqueno correspondente.[1] Isto é o inverso da hidroxenación catalítica de alquenos.
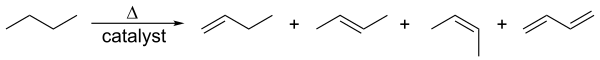
Este proceso tamén se coñece como reformado. Ambos os procesos son endotérmicos e diríxense cara á formación do alqueno a altas temperaturas por entropía.
A síntese catalítica de α-alquenos maiores (do tipo RCH=CH2) pode conseguirse tamén por unha reacción do etileno co composto organometálico trietilaluminio en presenza de níquel, cobalto ou platino.
Reaccións de eliminación
[editar | editar a fonte]Un dos métodos principais para a síntese de alquenos no laboratorio é a eliminación de haluros de alquilo, alcohois e compostos similares. O máis común é a β-eliminación por medio do mecanismo E2 ou E1,[10] pero tamén se coñecen as α-eliminacións.
O mecanismo E2 proporciona un método máis fiable de β-eliminación que o E1 na maioría das sínteses de alquenos. A maioría das eliminacións E2 empezan cun alquil haluro ou alquil sulfonato éster (como un tosilato ou triflato). Cando se usa un alquil haluro, a reacción chámase deshidrohaloxenación. Para os produtos non simétricos, os alquenos máis substituídos (aqueles con menos hidróxenos unidos ao C=C) tenden a predominar (ver a regra de Zaitsev). Dous métodos comúns de reaccións de eliminación son a deshidrohaloxenación de alquil haluros e a deshidratación de alcohois. Un exemplo típico móstrase máis abaixo; nótese que, se é posible, o H é anti con respecto ao grupo saínte, incluso se isto orixina o isómero Z, que é menos estable.[11]
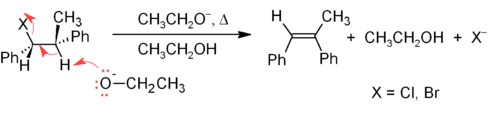
Os alquenos poden sintetizarse a partir de alcohois por medio dunha deshidratación, e nese caso a auga pérdese polo mecanismo E1. Por exemplo, a deshidratación de etanol produce eteno:
Un alcohol pode tamén ser convdertido nun mellor grupo saínte (por exemplo, xantato), para así permitir unha syn-eliminación máis suave como a eliminación Chugaev e a eliminación Grieco. As reaccións relacionadas inclúen eliminacións por β-haloéteres (a síntese de olefinas de Boord) e ésteres (pirólise de éster).
Os alquenos poden prepararse indirectamente a partir de alquil aminas. A amina ou amoníaco non é un grupo saínte axeitado, así que primeiro a amina se alquila (como na eliminación de Hofmann) ou oxidase a un óxido de amina (a reacción de Cope) para unha eliminación suave. A reacción de Cope é unha syn-eliminación que ocorre a ou por debaixo de 150 °C, por exemplo:[12]

A eliminación de Hofmann é pouco común porque o alqueno menos substituído (non de Saytseff) é xeralmente o produto principal.
Os alquenos xéranse a partir de α-halosulfonas na reacción de Ramberg–Bäcklund, por medio de intermediarios sulfonas de aneis de tres membros.
Síntese a partir de compostos carbonilo
[editar | editar a fonte]Outro importante método para a síntese de alquenos implica a construción dun novo enlace dobre carbono–carbono por acoplamento dun composto carbonilo (como un aldehido ou cetona) a un equivalente carbanión. Tales reaccións chámanse ás veces olefinacións. O máis coñecido destes métodos é a reacción de Wittig, pero hai outros métodos relacionados.
A reacción de Wittig implica a reacción dun aldehido ou cetona cun reactivo de Wittig (ou fosforano) do tipo Ph3P=CHR para producir un alqueno e Ph3P=O. O reactivo de Wittig prepárase doadamente a partir de trifenilfosfina e un haluro de alquilo. A reacción é bastante xeral e tolera moitos grupos funcionais, incluso ésteres, como neste exemplo:[13]
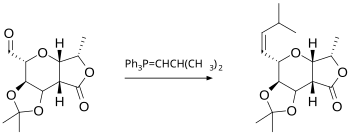
Relacionada coa reacción de Wittig está a olefinación de Peterson. Esta usa un reactivo baseado no silicio menos accesible en lugar do fosforano, pero permite a selección de produtos E ou Z. Se o que se desexa é un produto E, outra alternativa é a olefinación de Julia, que usa o carbanión xerado a partir dunha fenil sulfona. A olefinación de Takai baseada nun intermediario organocromo tamén orixina produtos E. Un composto de titanio chamado reactivo de Tebbe é útil para a síntese de compostos metileno; neste caso, reaccionan mesmo os ésteres e amidas.
Un par de compostos carbonilo poden tamén ser acoplados redutivamente (con redución) para xerar un alqueno. Os alquenos simétricos poden prepararse a partir dun só aldehido e cetona que se acopla con si mesmo, usando a redución de metal titanio (a reacción de McMurry). Se van ser acopladas dúas cetonas diferentes, pode usarse un método indirecto máis complexo como a reacción de Barton–Kellogg.
Unha soa cetona pode tamén converterse no alqueno correspondente por medio da súa tosilhidrazona, usando un metóxido de sodio (a reacción de Bamford–Stevens) ou un alquilitio (a reacción de Shapiro).
Síntese a partir de alquenos: metátese de olefinas e hidrovinilación
[editar | editar a fonte]Os alquenos poden pepararse por intercambio con outros alquenos nunha reacción chamada metátese de olefinas. Frecuentemente, a perda de gas eteno utilízase para impulsar a reacción cara a un produto desexado. En moitos casos, obtense unha mestura de isómeros xeométricos, pero a reacción tolera moitos grupos funcionais. O método é particularmente efectivo para a preparación de alquenos cíclicos, como na síntese de muscona:
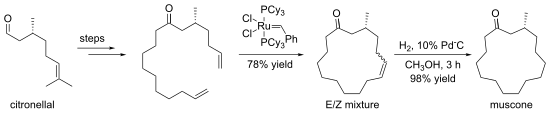
A hidrovinilación catalizada por metais de transición é outro importante método de síntese de alquenos que empeza polo propio alqueno.[14] En xeral, implica a adición dun hidróxeno e un grupo vinilo (ou un grupo alquenilo) ao dobre enlace. A reacción de hidrovinilación foi descrita primeiramente por Alderson, Jenner e Lindsey usando sales de rodio e rutenio, outros catalizadores metais empregados comunmente hoxe en día son o ferro, cobalto, níquel e paladio. A adición pode facerse de modo moi rexioselectivo e estereoselectivo, e as eleccións dos centros metálicos, ligandos, substratos e contraións a miúdo xogan un papel moi importante.[15][16][17] Recentes estudos mostraron que o uso de carbenos N-heterocíclicos con Ni pode ser útil para as preparacións selectivas de olefinas xerminais funcionalizadas ou alquenos 1,1-disubstituídos.[18][19]
Síntese a partir de alquinos
[editar | editar a fonte]A redución de alquinos é un método útil para a síntese estereoselectiva de alquenos disubstituídos. Se se desexa obter un cis-alqueno, úsase comunmente unha hidroxenación en presenza de catalizador de Lindlar (un catalizador heteroxéneo que consta de paladio depositado sobre carbonato de calcio e tratado con varias formas de chumbo), aínda que a hidroboración seguida de hidrólise proporciona unha aproximación alternativa. A redución de alquinos por sodio metálico e amoníaco líquido dá lugar ao trans-alqueno.[20]
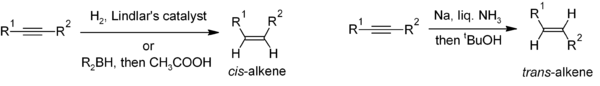
Para a preparación multisubstituída de alquenos, a carbometalación de alquinos pode dar lugar a unha gran variedade de derivados de alquenos.
Rearranxos e reaccións relacionadas
[editar | editar a fonte]Os alquenos poden sintetizarse a partir doutros alquenos por reaccións de rearranxo ou redistribución. Ademais da metátese de olefinas (descrita arriba), poden utilizarse moitas reaccións pericíclicas como a reacción eno e o rearranxo de Cope.
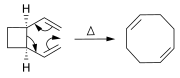
Na reacción de Diels–Alder, prepárase un derivado ciclohexeno a partir dun dieno e un reactivo ou alqueno deficiente en electróns.
Nomenclatura
[editar | editar a fonte]Aínda que a nomenclatura non sempre se segue xeralizadamente, segundo a IUPAC os alquenos son hidrocarburos cíclicos cun dobre enlace entre dous centros de carbono. As olefinas comprenden un amplo conxunto de alquenos cíclicos e acíclicos e tamén dienos e polienos.[21]
Nomes da IUPAC
[editar | editar a fonte]Para formar a raíz dos nomes da IUPAC para os alquenos, simplemente cambia o infixo -an- do composto parental a -en-. Por exemplo, CH3-CH3 é o alcano etANo. O nome do CH2=CH2 é, por tanto, etENo.
Nos alquenos superiores, nos que existen isómeros que difiren na localización do dobre enlace, úsase o seguinte sistema de numeración:
- Número da cadea carbonada máis longa que contén o dobre enlace na dirección que lle dá aos atomos de carbono do dobre enlace a cifra menor posible.
- Indícase a localización do enlace dobre pola localización do seu primeiro carbono.
- Noméanse os alquenos ramificados ou substituídos de maneira similar aos alcanos.
- Numéranse os átomos de carbono, localízanse e noméanse os grupos substituíntes, localízase o dobre enlace e noméase a cadea principal.

Notación Cis–trans
[editar | editar a fonte]- Artigo principal: Isomería cis-trans.
No caso específico de alquenos disubstituídos nos que os dous carbonos teñen cada un un substituínte, pode usarse a notación cis–trans. Se ambos os substituíntes están no mesmo lado do enlace, este defínese como cis-. Se os substituíntes están a ambos os lados do enlace, este considérase trans-.

Notación E–Z
[editar | editar a fonte]- Artigo principal: Notación E-Z.
Cando un alqueno ten máis dun substituínte (e especialmente necesario se ten 3 ou 4 substituíntes), a xeometría do dobre enlace descríbese usando as etiquetas E e Z. Estas etiquetas proceden das palabras alemás entgegen, que significa 'oposto', e zusammen, que significa 'xunto'. Os alquenos cos grupos de maior prioridade (o que se determina pola regra de prioridade de Cahn-Ingold-Prelog) no mesmo lado do dobre enlace teñen estes grupos xuntos e desígnanse como Z. Os alquenos cos grupos de maior prioridade en lados opostos desígnanse como E.

Grupos que conteñen dobres enlaces C=C
[editar | editar a fonte]A IUPAC recoñece dous nomes para os grupos de hidrocarburos que conteñen dobres enlaces carbono–carbono: grupo vinilo e grupo alilo.[2]

Notas
[editar | editar a fonte]- ↑ 1,0 1,1 1,2 Wade, L.G. (2006). Organic Chemistry (6th ed.). Pearson Prentice Hall. pp. 279. ISBN 1-4058-5345-X.
- ↑ 2,0 2,1 2,2 Moss, G. P.; Smith, P. A. S.; Tavernier, D. (1995). "Glossary of Class Names of Organic Compounds and Reactive Intermediates Based on Structure (IUPAC Recommendations 1995)". Pure and Applied Chemistry 67 (8–9): 1307–1375. doi:10.1351/pac199567081307.
- ↑ "Production: Growth is the Norm". Chemical and Engineering News 84 (28): 59. July 10, 2006. doi:10.1021/cen-v084n034.p059.
- ↑ Barrows, Susan E.; Eberlein, Thomas H. (2005). "Understanding Rotation about a C=C Double Bond". J. Chem. Educ. 82 (9): 1329. Bibcode:2005JChEd..82.1329B. doi:10.1021/ed082p1329.
- ↑ 5,0 5,1 Bansal, Raj K. (1998). "Bredt's Rule". Organic Reaction Mechanisms (3rd ed.). McGraw-Hill Education. pp. 14–16. ISBN 9780074620830.
- ↑ Fawcett, Frank S. (1950). "Bredt's Rule of Double Bonds in Atomic-Bridged-Ring Structures". Chem. Rev. 47 (2): 219–274. doi:10.1021/cr60147a003.
- ↑ "Bredt's Rule". Comprehensive Organic Name Reactions and Reagents 116: 525–528. 2010. doi:10.1002/9780470638859.conrr116.
- ↑ Streiwieser, A.; Heathcock, C.H.; Kosower, E.M. (1992). "11.6.G. Alkenes: Reactions: Free Radical Additions". Introduction to Organic Chemistry (4th ed.). New York: Macmillan. p. 288.
- ↑ Wade, L.G. (2006). Organic Chemistry (6th ed.). Pearson Prentice Hall. pp. 309. ISBN 1-4058-5345-X.
- ↑ Saunders, W. H. (1964). Patai, Saul, ed. The Chemistry of Alkenes. Wiley Interscience. pp. 149–150.
- ↑ Cram, D.J.; Greene, Frederick D.; Depuy, C. H. (1956). "Studies in Stereochemistry. XXV. Eclipsing Effects in the E2 Reaction1". Journal of the American Chemical Society 78 (4): 790–796. doi:10.1021/ja01585a024.
- ↑ Bach, R.D.; Andrzejewski, Denis; Dusold, Laurence R. (1973). "Mechanism of the Cope elimination". J. Org. Chem. 38 (9): 1742–3. doi:10.1021/jo00949a029.
- ↑ Snider, Barry B.; Matsuo, Y; Snider, BB (2006). "Synthesis of ent-Thallusin". Org. Lett. 8 (10): 2123–6. PMC 2518398. PMID 16671797. doi:10.1021/ol0605777.
- ↑ Vogt, D. (2010). "Cobalt-Catalyzed Asymmetric Hydrovinylation". Angew. Chem. Int. Ed. 49 (40): 7166–8. PMID 20672269. doi:10.1002/anie.201003133.
- ↑ Grutters, M. M. P.; Muller, C.; Vogt, D. (2006). "Highly Selective Cobalt-Catalyzed Hydrovinylation of Styrene". J. Am. Chem. Soc. 128 (23): 7414–5. PMID 16756275. doi:10.1021/ja058095y.
- ↑ Hilt, G.; Danz, M.; Treutwein, J. (2009). "Cobalt-Catalyzed 1,4-Hydrovinylation of Styrenes and 1-Aryl-1,3-butadienes". Org. Lett. 11 (15): 3322–5. PMID 19583205. doi:10.1021/ol901064p.
- ↑ Sharma, R. K.; RajanBabu, T. V. (2010). "Asymmetric Hydrovinylation of Unactivated Linear 1,3-Dienes". J. Am. Chem. Soc. 132 (10): 3295–7. PMC 2836389. PMID 20163120. doi:10.1021/ja1004703.
- ↑ Ho, C.-Y.; He, L. (2010). "Catalytic Intermolecular Tail-to-Tail Hydroalkenylation of Styrenes with alpha-Olefins: Regioselective Migratory Insertion Controlled by a Nickel/N-Heterocyclic Carbene". Angew. Chem. Int. Ed. 49 (48): 9182–9186. PMID 20853303. doi:10.1002/anie.201001849.
- ↑ Ho, C.-Y.; He, L. (2012). "Shuffle Off the Classic Beta-Si Elimination by Ni-NHC Cooperation: Implication for C–C Forming Reactions Involving Ni-Alkyl-Beta-Silanes". Chem. Commun. 48 (10): 1481–1483. PMID 22116100. doi:10.1039/c1cc14593b.
- ↑ Zweifel, George S.; Nantz, Michael H. (2007). Modern Organic Synthesis: An Introduction. New York: W. H. Freeman & Co. pp. 366. ISBN 0-7167-7266-3.
- ↑ http://goldbook.iupac.org/O04281.html
Véxase tamén
[editar | editar a fonte]Outros artigos
[editar | editar a fonte]Ligazóns externas
[editar | editar a fonte]- Nomenclatura
- Regra A-3. Compostos insaturados e radicais univalentes [1] IUPAC Blue Book.
- Regra A-4. Radicais bivalentes e multivalentes [2] IUPAC Blue Book.
- Regra A-11.3, A-11.4, A-11.5 Hidocarburos monocíclicos insaturados e substituíntes [3] IUPAC Blue Book.
- Regra A-23. Compostos hidroxenados de hidrocarburos policíclicos fusionados [4] IUPAC Blue Book.