ホウ酸
表示
| ホウ酸 | |
|---|---|
|

|

| |
ホウ酸 | |
別称 オルトホウ酸 サッソライト | |
| 識別情報 | |
| CAS登録番号 | 10043-35-3 |
| E番号 | E284 (防腐剤) |
| |
| |
| 特性 | |
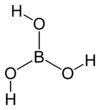
| 化学式 | B(OH)3 |
| モル質量 | 61.833 g/mol |
| 外観 | White crystalline solid |
| 密度 | 1.435 g/cm3, 固体 |
| 融点 |
169°C (分解) |
| 水への溶解度 | 5.7 g/100 ml (25°C) |
| 酸解離定数 pKa | 9.24 |
| 構造 | |
| 分子の形 | 平面三角形 |
| 双極子モーメント | 0 |
| 危険性 | |
| NFPA 704 | |
| 引火点 | 無し |
| 関連する物質 | |
| 関連物質 | 酸化ホウ素 ホウ砂 |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
ホウ酸(Boric acid)は、殺菌剤、殺虫剤、難燃剤、原子力発電におけるウランの核分裂の制御、そして他の化合物の合成に使われる弱酸の無機化合物である。化学式はH3BO3だが、ときどきB(OH)3とも書かれる。常温常圧では無色の結晶または白色粉末で、水溶液では弱い酸性を示す。硼酸の鉱物は硼酸石(サッソライト)と呼ばれる。
合成
ホウ酸は主にホウ酸塩鉱物に硫酸を反応させて作られる。世界最大のホウ酸塩の産出地はトルコのEti Mine Worksである[1]。
毒性
ホウ酸を吸い込んだりすると、吐き気・嘔吐・下痢などを引き起こす。
用途
水酸化カリウム水溶液の中和剤としても用いられる。工業用メーカーは、アメリカ、トルコ、ロシア、チリ、ペルー、アルゼンチン。日本は全量を輸入に依存。用途はホウ酸塩ガラス、ガラス繊維、ホウ素系合金鉄。
ホウ素の高い中性子吸収能力を利用して、原子炉の冷却材にホウ酸を溶かして、原子炉出力の制御に用いられている。
小学校5年の理科の実験(物の溶け方)で溶解度の実験を行なう際,食塩水(塩化ナトリウムの水溶液)と並ぶ代表的な試薬。
この他、ゴキブリ駆除にほう酸ダンゴが使用される場合がある。米ぬかやじゃがいもにほう酸を混入させることで自作することも可能だが、市販品も存在する。
結晶構造
ホウ酸の結晶は水素結合による層状構造からなる。層同士の距離は318ピコメートルである。
 |
 |
脚注
関連項目

