Kyselina dusičná
| Kyselina dusičná | |||||||||||||
 | |||||||||||||
 | |||||||||||||
| Všeobecné vlastnosti | |||||||||||||
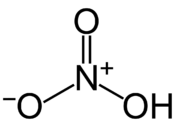
| Sumárny vzorec | HNO3 | ||||||||||||
| Synonymá | lúčavka, Aqua fortis, Salpetre acid | ||||||||||||
| Vzhľad | bezfarebná látka | ||||||||||||
| Fyzikálne vlastnosti | |||||||||||||
| Molekulová hmotnosť | 63,0129 g/mol amu | ||||||||||||
| Teplota topenia | −42 °C (250,2 K) | ||||||||||||
| Teplota varu | 83 °C (350 K) | ||||||||||||
| Hustota | 1,51 g/cm3 (sulfur) | ||||||||||||
| Rozpustnosť | neobmedzene miešateľná | ||||||||||||
| Teplota vzplanutia | 287 °C | ||||||||||||
| |||||||||||||
| Ďalšie informácie | |||||||||||||
| Číslo CAS | 7697-37-2 | ||||||||||||
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |||||||||||||
Kyselina dusičná alebo lúčavka (lat. aqua fortis) je anorganická kyselina. Čerstvá a čistá je bezfarebná, staršia má žltkastú farbu, kvôli hromadeniu oxidov dusíka. Je to silná žieravina, poškodzuje pokožku a sliznicu, jej výpary sú vysoko nebezpečné. Po kyseline sírovej je druhou najvýznamnejšou kyselinou. Koncentrovaná je 65 – 68%. Roztok, obsahujúci viac ako 86 % kyseliny dusičnej, sa nazýva dymivá kyselina dusičná. V závislosti na obsahu oxidu dusičitého v roztoku poznáme bielu, resp. červenú dymivú kyselinu dusičnú.
Vlastnosti
[upraviť | upraviť zdroj]Je nestála, na vzduchu a svetle sa rozkladá na červenohnedý jedovatý plynný oxid dusičitý:
- 4 HNO3 → 2 H2O + 4 NO2 + O2
preto sa uchováva vo fľašiach s tmavým sklom a dvojitým uzáverom. Čistá bezvodá kyselina dusičná je bezfarebná pohyblivá kvapalina s hustotou 1,512 g / ml, ktorá tuhne pri teplote −42 °C na biele kryštály a vrie pri teplote 83 °C. Pôsobením svetla a tepla sa rozkladá na oxid dusičitý. Rozkladu možno zabrániť uchovávaním bezvodej kyseliny dusičnej pod 0 °C. Zvyšky oxidu dusičitého farbia kyselinu na žlto, pri vyšších teplotách na červeno. Čistá kyselina vypúšťa biele výpary, keď je vystavená pôsobeniu vzduchu, zatiaľ čo čiastočne rozložená červenohnedé výpary (tzv. červená dymivá kyselina dusičná, príp. 16 molárna kyselina dusičná). Oxidy dusíka sú rozpustné v kyseline dusičnej a ovplyvňujú viac-menej všetky fyzikálne vlastnosti tejto kyseliny, hlavne tlak pár nad kvapalinou a teplotu varu, v závislosti od ich koncentrácie.
Technická kyselina je 68 % (15 molárna). Hustota koncentrovanej kyseliny je 1,42 g / ml. Biela dymivá kyselina dusičná, nazývaná aj 100 %-ná, je veľmi podobná bezvodej kyseline dusičnej. Špecifický pre túto koncentráciu je 2 % obsah vody a max. 0,5 % obsah rozpusteného oxidu dusičitého. Predávaná koncentrácia dymivej kyseliny dusičnej obsahuje 90 % HNO3 a má hustotu 1,5 g / ml. Táto koncentrácia sa používa pri výrobe trhavín. Červená dymivá kyselina dusičná obsahuje podstatné množstvo rozpusteného oxidu dusičitého, až 17 %. Kvôli tejto skutočnosti je jej hustota nižšia ako 1,49 g / ml. Inhibovaná kyselina dusičná sa vyrába pridaním 0,6 až 0,7 % fluorovodíka, ktorý vytvára vrstvu fluoridu na vnútornej strane kovovej nádrže, čím ju chráni pred koróziou.
Acidobázické vlastnosti
[upraviť | upraviť zdroj]Disociačná konštanta kyseliny dusičnej je zvyčajne menej ako -1, čo znamená, že táto kyselina je v roztoku úplne disociovaná, okrem extrémne kyslých roztokov:
- HNO3(l) + H2O(l) ↔ H3O+(aq) + NO3−(aq)
Kyselina dusičná, vzhľadom ku kyseline sírovej, vystupuje ako báza:
- HNO3 + 2H2SO4 ↔ NO2+ + H3O+ + 2HSO4–
Oxidačné vlastnosti
[upraviť | upraviť zdroj]Kyselina dusičná je silné oxidačné činidlo, ako ukazuje jej veľký kladný redukčný potenciál. V závislosti na koncentrácii kyseliny, teplote a druhu oxidovanej látky, vznikajú rôzne produkty. Reaguje so všetkými kovmi, okrem drahých kovov a ich zliatin. Všeobecným pravidlom je, že oxidačné reakcie vznikajú primárne pôsobením konc. kyseliny, pričom vzniká oxid dusičitý.
Reakcie s kovmi
[upraviť | upraviť zdroj]Pretože kyselina dusičná reaguje s väčšinou kovov, môže byť využitá ako všeobecné činidlo, použité pri chem. skúškach kovov. Niektoré drahé kovy, ako čisté zlato, nereagujú s kyselinou dusičnou, ale s lúčavkou kráľovskou. Ak pôsobí lúčavka kráľovská na zlaté zliatiny, obsahujúce striebro,meď a menej ako 14 karátov zlata, dochádza k zmene farby povrchu zliatiny. Tak je možné odhaliť nízky obsah zlata v zliatine. Veľmi neušľachtilé kovy, ako horčík, reagujú s kyselinou dusičnou za vývoja vodíka:
- Mg + 2 H+ → Mg2+ + H2
S viac ušľachtilými kovmi reaguje kyselina rôzne, v závislosti od koncentrácie a teploty. Napríklad meď reaguje pri izbovej teplote so zriedenou kyselinou za vývoja oxidu dusnatého, ktorý reaguje so vzdušným kyslíkom na oxid dusičitý. Pri väčšej koncentrácii kyseliny vzniká priamo oxid dusičitý:
- 3 Cu + 8 HNO3 → 3 Cu2+ + 2 NO + 4 H2O + 6 NO3-
- Cu + 4 H+ + 2 NO3− → Cu2+ + 2 NO2 + 2 H2O
Pasivácia
[upraviť | upraviť zdroj]Vzniká u kovov, napr. chróm, železo a hliník, ktoré sú rozpustné v zriedenej kyseline, ale koncentrovaná kyselina vytvára na ich povrchu oxid kovu, ktorý chráni kov pred ďalším rozpúšťaním. Typická koncentrácia kyseliny, ktorá vyvoláva pasiváciu, je 18 až 22 % hmotnostných.
Reakcie s nekovmi
[upraviť | upraviť zdroj]Kyselina dusičná reaguje s mnohými nekovmi, okrem dusíka, kyslíka, vzácnych plynov, kremíka a halogénov, niektoré reakcie môžu byť výbušné. Zvyčajne vzniká oxid dusičitý pri koncentrovanej a oxid dusnatý pri zriedenej kyseline:
- C + 4 HNO3 → CO2 + 4 NO2 + 2 H2O
- 3 C + 4 HNO3 → 3 CO2 + 4 NO + 2 H2O
Xantoproteínový test
[upraviť | upraviť zdroj]Kyselina dusičná vytvára s bielkovinami žlté nitrované produkty, tzv. xantoproteínová reakcia. Tento test využíva pridanie koncentrovanej kyseliny k skúmanej látke a zahriatie zmesi. Ak bielkoviny vo vzorke obsahujú aromatické aminokyseliny, zmes zožltne. Po pridaní silnej zásady, ako je amoniak, zmes zoranžovie. Tieto farebné zmeny sú spôsobené nitrovanými aromatickými jadrami v bielkovine.
Výroba
[upraviť | upraviť zdroj]Kyselina dusičná sa vyrába reakciou oxidu dusičitého s vodou alebo peroxidom vodíka:
- 2 NO2 + H2O2 → 2 HNO3
Takmer čistá kyselina môže byť pripravená pridaním kyseliny sírovej k dusičnanu a zahriatím zmesi v olejovom kúpeli. Vzniknuté kyslé výpary skondenzujú v chladiči. Zriedená kyselina dusičná môže byť skoncentrovaná destiláciou na max. 68 %. Vyššiu koncentráciu možno získať destiláciou s kyselinou sírovou, alebo dusičnanom horečnatým, tieto látky pôsobia ako dehydratačné činidlá. Takúto destiláciu treba robiť v celosklenenej aparatúre za zníženého tlaku, aby sa zabránilo rozkladu kyseliny.
Priemyselne sa vyššia koncentrácia ako 68 % dosahuje rozpúšťaním ďalšieho oxidu dusičitého v koncentrovanej kyseline dusičnej. Kyselina sa priem. vyrába Ostwaldovým procesom, podľa nemeckého chemika Friedricha Wilhelma Ostwalda. V tomto procese sa bezvodý amoniak oxiduje na oxid dusnatý v prítomnosti platiny, alebo ródia ako katalyzátora, pri teplote okolo 500 K a tlaku 9 barov. Oxid dusnatý potom reaguje s kyslíkom vo vzduchu na oxid dusičitý, ktorý absorpciou vo vode vytvára kyselinu dusičnú a oxid dusnatý:
- 4 NH3 + 5 O2 → 4 NO + 6 H2O
- 2 NO + O2 → 2 NO2
- 3 NO2 + H2O → 2 HNO3 + NO
V minulosti sa kyselina dusičná produkovala Birkeland-Eydeovým procesom, kde sa vzdušný dusík oxidoval kyslíkom zo vzduchu pri vysokej teplote pomocou elektrického oblúka. Výťažok oxidu dusnatého pri tejto metóde bol len 4 %, čím vznikala len zriedená kyselina.
Laboratórna syntéza
[upraviť | upraviť zdroj]V laboratóriu môže byť kyselina dusičná pripravená reakciou dusičnanu s koncentrovanou kyselinou sírovou a destiláciou tejto zmesi:
- H2SO4 + NO3− → HSO4– + HNO3
Použitie
[upraviť | upraviť zdroj]Kyselina dusičná sa používa na výrobu umelých hnojív, trhavín, leptanie a rozpúšťanie kovov, ako zložka lúčavky kráľovskej na čistenie a extrakciu zlata a v syntéze chemikálií.
Raketové palivo
[upraviť | upraviť zdroj]Kyselina dusičná bola použitá v rôznych formách ako oxidačné činidlo v tekutom raketovom palive. Tieto formy zahŕňajú červenú a bielu dymivú kyselinu dusičnú, zmesi s kyselinou sírovou a fluorovodíkom.
Chemický reagent
[upraviť | upraviť zdroj]V organickej syntéze sa používa na zavádzanie nitroskupiny do organických zlúčenín. Pri zmiešaní s koncentrovanou kyselinou sírovou vzniká nitrónium NO2+, ktoré elektrofilne reaguje s aromatickými látkami, tzv. nitrácia. V elektrochémii sa kyselina dusičná používa na dopovanie organických polovodičov a čistenie surových nanovlákien.
Stolárstvo
[upraviť | upraviť zdroj]V nízkej koncentrácii, asi 10 %, sa kyselina dusičná používa na vytvorenie starodávneho vzhľadu borovicových a javorových výrobkov. Vzniknuté šedozlaté sfarbenie je veľmi podobné starému vosku, alebo naolejovanému drevu.
Iné použitie
[upraviť | upraviť zdroj]Roztok kyseliny dusičnej v alkohole (nital) sa používa na leptanie kovov, aby sa odkryla ich mikroštruktúra. Komerčne dostupný vodný roztok 5 až 30 % kyseliny dusičnej a 15 až 40 % kyseliny fosforečnej sa používa na čistenie prístrojov v potravinárstve a mliekarenstve, najmä na odstránenie vápenatých a horečnatých zlúčenín, ktoré sa dostali do výrobného procesu použitím tvrdej vody.
Bezpečnosť
[upraviť | upraviť zdroj]Kyselina dusičná je silné oxidovadlo, reakcie s kyanidmi, karbidmi a práškovými kovmi môžu prebiehať explozívne. Reakcie s mnohými organickými látkami, napr. terpentínom, sú prudké a hypergolické (samozápalné). Koncentrovaná kyselina farbí ľudskú kožu na žlto (reakcia s keratínom).
História
[upraviť | upraviť zdroj]Prvá zmienka o lúčavke je v pseudo-Geberovom De Inventione Veritatis, kde ju získaval pražením zmesi liadku, kamenca a modrej skalice. Glauber vymyslel proces používaný dodnes, kedy zohrieval liadok s vitriolom.
Zdroj
[upraviť | upraviť zdroj]Tento článok je čiastočný alebo úplný preklad článku Nitric acid na anglickej Wikipédii.


