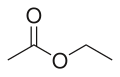
Acetato de etila
Alerta sobre risco à saúde
|
|

|
| Nome IUPAC
|
Etanoato de etila
|
| Nome sistemático
|
Ethyl ethanoate
|
| Outros nomes
|
Éster de etila, acetato de etila, éster acético, éster de etanol
|
| Identificadores
|
| Número CAS
|
141-78-6
|
| Número RTECS
|
AH5425000
|
| SMILES
|
|
| Propriedades
|
| Fórmula molecular
|
C4H8O2
|
| Massa molar
|
88.105 g/mol
|
| Aparência
|
líquido incolor
|
| Densidade
|
0.897 g/cm³, líquido
|
| Ponto de fusão
|
-83.6 °C, 190 K, -118 °F
|
| Ponto de ebulição
|
77 °C, 350 K, 171 °F
|
| Solubilidade em água
|
8.7 g/100 mL (20 °C)
|
Solubilidade em etanol,
acetona, éter dietílico,
benzeno
|
Miscível
|
| Índice de refracção (nD)
|
1.3720
|
| Viscosidade
|
0.426 cP at 25 °C
|
| Estrutura
|
| Momento dipolar
|
1.78 D
|
| Riscos associados
|
Principais riscos
associados
|
Altamente Inflamável (F),
Irritante (Xi)
|
| NFPA 704
|
|
| Frases R
|
R11, R36, R66, R67
|
| Frases S
|
S16, S26, S33
|
| Ponto de fulgor
|
-4 °C
|
| LD50
|
11.3 g/kg, em ratos
|
| Compostos relacionados
|
| Ésteres carboxílicos relacionados
|
Acetato de metila
Acetato de vinila
Anidrido acético (acetato de acetila)
Acetato de propila
Acetato de butila
Metanoato de etila
Glicolato de etila
Propionato de etila
|
| Compostos relacionados
|
Ácido acético
Etanol
N-etil acetamida
Tioacetato de etila
Éter dietílico
Anidrido acético
|
| Página de dados suplementares
|
| Estrutura e propriedades
|
n, εr, etc.
|
| Dados termodinâmicos
|
Phase behaviour
Solid, liquid, gas
|
| Dados espectrais
|
UV, IV, RMN, EM
|
Exceto onde denotado, os dados referem-se a
materiais sob condições normais de temperatura e pressão
Referências e avisos gerais sobre esta caixa.
Alerta sobre risco à saúde.
|
[1]Acetato de etila ou Acetato de etilo[2] (Fórmula: CH3COOCH2CH3) é um éster simples, que possui alta aplicação industrial. É um ótimo solvente, relativamente muito volátil. É facilmente produzido industrialmente ou em laboratórios acadêmicos, a partir da reação de ácido acético(acido carboxílico) com etanol, em presença de ácido sulfúrico.
No passado, já foi usado em medicina como um antiespasmódico (contra convulsões), e hoje é usado como um solvente. Atualmente utiliza-se em substituição à acetona para remoção de esmaltes em suas unhas. Acredita-se que seja menos prejudicial e nocivos às unhas e à pele. [3]


