Nitrato de sodio
| Nitrato de sodio | ||
|---|---|---|
 | ||
 | ||
 | ||
| Nombre IUPAC | ||
| Trioxonitrato (V) de sodio | ||
| General | ||
| Otros nombres |
Nitrato de sodio Nitrato sódico | |
| Fórmula estructural |
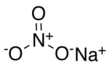 | |
| Fórmula molecular | NaNO3 | |
| Identificadores | ||
| Número CAS | 7631-99-4[1] | |
| Número RTECS | WC5600000 | |
| ChEBI | 63005 | |
| ChEMBL | CHEMBL1644698 | |
| ChemSpider | 22688 | |
| DrugBank | DB15952 | |
| PubChem | 517680 24268, 517680 | |
| UNII | 8M4L3H2ZVZ | |
| Propiedades físicas | ||
| Apariencia | Polvo blanco o cristales incoloros | |
| Densidad | 2260 kg/m³; 2,26 g/cm³ | |
| Masa molar | 85 g/mol | |
| Punto de fusión | 581 K (308 °C) | |
| Punto de ebullición | 653,15 K (380 °C) | |
| Propiedades químicas | ||
| Solubilidad en agua | 92,1 g/100 ml (25 °C) | |
| Peligrosidad | ||
| NFPA 704 |
0
1
0
OX
| |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El nitrato de sodio o nitrato sódico es un nitrato cuya fórmula es NaNO3 , es un compuesto para formar el salitre junto con el nitrato de potasio.
El nitrato de sodio es un sólido blanco con gran afinidad por el agua y muy soluble en agua. Es una fuente fácilmente disponible del anión nitrato (NO3−), que es útil en varias reacciones llevadas a cabo a escala industrial para la producción de fertilizantes, pirotecnia, bombas de humo y otros explosivos, vidrio y cerámica esmaltes vítreos, conservantes de alimentos (especialmente carnes) y propelente sólido de cohetes. Se ha extraído extensamente para estos fines.
Actualmente se obtiene por síntesis química, a partir del ácido nítrico, y este a partir del amoniaco.
Historia
[editar]El primer cargamento de salitre a Europa llegó a Inglaterra desde Perú en 1820 o 1825, justo después de la independencia de ese país de España, pero no encontró compradores y fue arrojado al mar para evitar el peaje aduanero.[2][3] Con el tiempo, sin embargo, la extracción de salitre sudamericano se convirtió en un negocio rentable (en 1859, sólo Inglaterra consumió 47.000 toneladas métricas[3]). Chile luchó en la Guerra del Pacífico (1879-1884) contra los aliados Perú y Bolivia y se hizo con sus más ricos yacimientos de salitre. En 1919, Ralph Walter Graystone Wyckoff determinó su estructura cristalina mediante cristalografía de rayos X.
Síntesis
[editar]Entre 1830 y 1920 aproximadamente la mayoría del nitrato de sodio provenía de los vastos depósitos de salitre de los desiertos chilenos, y también peruanos y bolivianos. A partir del salitre se obtenían ácido nítrico, nitrato de sodio y nitrato de potasio. El nitrato de sodio era purificado y posteriormente se lo hacía reaccionar en una disolución con cloruro de potasio (KCl), en la cual el nitrato de potasio, menos soluble, cristalizaba.
Tras la Primera Guerra Mundial la generalización del proceso Haber-Bosch permite la síntesis industrial del amoniaco a bajo precio. A partir del amoniaco sintético se obtiene ácido nítrico y de este los nitratos, sobre todo el nitrato de sodio y el de potasio. La extracción del salitre deja de ser rentable y decae.
En el laboratorio el nitrato de sodio se obtiene por neutralización de bases como el hidróxido de sodio (NaOH) o el carbonato de sodio (Na2CO3) con ácido nítrico HNO3.
En la naturaleza existen yacimientos importantes naturales de minerales con alto contenido en nitrato de sodio, como nitratina o salitre, muy abundantes en Chile.
Yacimientos
[editar]Las mayores acumulaciones de nitrato de sodio natural se encuentran en Chile y Perú, donde las sales de nitrato se unen dentro de depósitos minerales llamados caliche mineral .[4] Los nitratos se acumulan en la tierra a través de la precipitación de la niebla marina y la oxidación/desecación del rocío del mar, seguida de la sedimentación gravitatoria de NaNO3, KNO3, NaCl, Na2SO4, y yo, en la atmósfera cálida y seca del desierto.[5] La aridez extrema/los ciclos de lluvia torrencial de El Niño/La Niña favorecen la acumulación de nitratos a través de la aridez y la disolución/removilización/transporte del agua hacia las laderas y las cuencas; el movimiento de la solución capilar forma capas de nitratos; el nitrato puro forma vetas raras. Durante más de un siglo, el suministro mundial del compuesto se extraía casi exclusivamente del desierto de Atacama en el norte de Chile hasta que, a principios del siglo XX, los químicos alemanes Fritz Haber y Carl Bosch desarrollaron un proceso para producir amoníaco de la atmósfera a escala industrial (ver proceso de Haber). Con el inicio de la Primera Guerra Mundial, Alemania comenzó a convertir el amoníaco de este proceso en un salitre chileno sintético, que era tan práctico como el compuesto natural en la producción de pólvora y otras municiones. Para la década de 1940, este proceso de conversión resultó en una disminución dramática en la demanda de nitrato de sodio obtenido de fuentes naturales.
Chile aún tiene las mayores reservas de caliche, con minas activas en lugares como Valdivia, María Elena y Pampa Blanca, y allí solía llamarse oro blanco. Las antiguas comunidades salitreras chilenas de Humberstone y Santa Laura fueron declaradas Patrimonio de la Humanidad por la UNESCO en 2005.
Propiedades
[editar]Se trata de una sustancia incolora, inodora y altamente oxidante. Mezclado con sustancias orgánicas puede provocar explosiones. El nitrato es sólo ligeramente tóxico (LD50 = 1267 mg/kg) pero puede ser transformado en nitrito con actividades fisiológicas mayores y más dañinas.
Propiedades físicas
[editar]El nitrato de sodio a temperatura ambiente es un líquido cristalino, de color blanco e inodoro. Los cristales pertenecen al sistema cristalino trigonal o romboédrico. La unidad de romboedro del nitrato de sodio es una estructura centrada en el cos que contiene dos grupos ,[6] grupo espacial 3m.[7] Su punto de fusión es de 308 °C y se descompone a 380 °C en òxido de dinitrógeno y òxido de sodio. Su densidad es de 2,26 g/cm³.
En agua, el nitrato de sodio es muy soluble, 73 g en 100 g de agua a 0 °C y 91,2 g en 100 g de agua a 25 °C. Su solubilidad aumenta con la temperatura. Es soluble en etanol y metanol. Sus disoluciones en agua son neutras (pH = 7). En aire húmedo es muy ávido de agua.[8]
Propiedades químicas
[editar]El nitrato de sodio es un agente oxidante fuerte; reacciona violentamente con materiales inflamables, combustibles, mudas compuestas orgánicas, y otros agentes reductores como aluminio granulado o en polvo, magnesio y otros metales, que provocan incendios y explosiones.
Reacciones a base de ácido
[editar]Con los ácidos fuertes el nitrato de sodio actúa como base. Es el caso de la reacción con el ácido sulfúrico que se emprende para la obtención industrial de ácido nítrico:
Oxidación
[editar]
Las propiedades oxidantes del nitrato de sodio se han emprendido para preparar explosivos o para preparar con glúcidos propulsores para cohetes. La reacción con glucosa es:[9]
Descomposición
[editar]A temperaturas por debajo de los 380 °C, ya en estado líquido, y por debajo de los 800 °C el nitrato de sodio se descompone en nitrito de sodio y oxígeno:[10]
.
Si la temperatura supera los 800 °C se produce òxido de sodio, nitrógeno y oxígeno:
Aplicaciones
[editar]- Debido a su contenido en nitrógeno se utiliza como fertilizante.
- Fundido en una mezcla con carbonato de sodio se usa en la obtención del cromo de sus minerales por oxidación de este metal a cromato. (CrO42-).
- Como aditivo para el cemento.
- Es uno de los ingredientes mayoritarios de ciertos tipos de pólvora negra.
- Debido a que al quemarse genera oxígeno, ha sido empleado en varias ocasiones a lo largo de la historia para conseguir un fuego que ardiese bajo el agua, como es el caso del fuego griego.
- Es un agente preventivo de la enfermedad conocida como botulismo.
Agricultura
[editar]
El nitrato de sodio proporciona una fuente de nutrición de nitrógeno inmediatamente disponible para las plantas, ya que es altamente soluble. Se ha utilizado como fuente de nutrición de nitrógeno desde mediados del siglo XIX y tiene una distinguida historia como valioso material fertilizante. Ha sido la fuente preferida de nutrición de las plantas para muchos cultivos, especialmente para el tabaco, que se suele abonar con una forma de fertilizante a base de nitrato.
El nitrato de sodio está aprobado por el Programa Nacional Orgánico de Estados Unidos para su uso como fuente suplementaria de nutrición de Nitrógeno. El uso permitido reconoce que la mineralización de las fuentes orgánicas de Nitrógeno basadas en el carbono no siempre es lo suficientemente rápida como para satisfacer la demanda de N del cultivo en crecimiento. Este déficit entre la liberación de Nitrógeno y la demanda de la planta puede ser superado con aplicaciones apropiadas de nitrato de sodio.
Alimentos
[editar]El nitrato de sodio es también un aditivo alimentario utilizado como conservante y fijador del color en carnes curadas y aves de corral; figura con su número INS 251 o número E E251. Su uso está aprobado en la UE,[11] US Food and Drug Administration:[12] y Australia y Nueva Zelanda.[13] El nitrato de sodio no debe confundirse con el nitrito de sodio, que también es un aditivo alimentario y conservante común utilizado, por ejemplo, en las carnes frías.
Uso para la purificación de oro
[editar]El nitrato de sodio se utiliza, entre otras cosas, para reciclar el oro de los componentes electrónicos o el polvo de las joyas. Puede utilizarse como sustituto en polvo del ácido nítrico para preparar agua regia.
El agua regia (etimología: agua real) es una mezcla de ácido nítrico concentrado y ácido clorhídrico utilizada para disolver el oro. El principio es que el ácido clorhídrico facilita la disolución del oro al complejizar la fracción ya oxidada por el ácido nítrico con iones de cloruro. Como el nitrato de sodio es una sal de ácido nítrico y sodio y el ion sodio no influye en la reacción, el nitrato de sodio puede sustituir al ácido nítrico. Esta sustitución se utiliza simplemente porque el nitrato de sodio es más fácil de obtener y manejar para el aficionado.
La secuencia de reacciones químicas en la extracción de oro utilizando nitrato de sodio incluye la neutralización del ácido (a menudo con urea), y luego la precipitación del oro como una lechada (a menudo con metabisulfito de sodio, Na
2S
2O
5. A continuación, la pasta se funde para aglomerar el metal dorado.
Preparación de pólvora negra
[editar]En la preparación de la pólvora negra comercial, el nitrato de potasio u otro nitrato (por ejemplo, el nitrato de sodio) suele estar recubierto de grafito (una forma de carbono). Esto ayuda a evitar la acumulación de cargas electrostáticas, reduciendo la posibilidad de que una chispa perdida encienda prematuramente la mezcla.
Efectos sobre la salud
[editar]Los estudios han demostrado una relación entre el aumento de los niveles de nitratos y el aumento de las muertes por ciertas enfermedades, incluyendo la enfermedad de Alzheimer, la diabetes mellitus, el cáncer de estómago y la enfermedad de Parkinson: posiblemente a través del efecto dañino de las nitrosaminas en el ADN; sin embargo, se ha hecho poco para controlar otras posibles causas en los resultados epidemiológicos.[14] Las nitrosaminas, formadas en las carnes curadas que contienen nitrato y nitrito de sodio, se han relacionado con el cáncer gástrico y el cáncer de esófago.[15] El nitrato de sodio y el nitrito están asociados a un mayor riesgo de cáncer colorrectal.[16]
En las últimas décadas existen pruebas sustanciales, facilitadas por un mayor conocimiento de los procesos patológicos y de la ciencia, que apoyan la teoría de que la carne procesada aumenta el riesgo de cáncer de colon y que esto se debe al contenido de nitrato. Una pequeña cantidad del nitrato que se añade a la carne como conservante se descompone en nitrito, además de cualquier nitrito que también se pueda añadir. El nitrito reacciona entonces con los alimentos ricos en proteínas (como la carne) para producir NOCs cancerígenos (compuestos nitrosos). Los NOC pueden formarse tanto cuando se cura la carne como en el cuerpo al digerirla.[17].
Sin embargo, hay varias cosas que complican la comprensión, por lo demás sencilla, de que "los nitratos en los alimentos aumentan el riesgo de cáncer": Se sabe que las plantas de consumo habitual son fuentes ricas en nitratos. De hecho, la exposición a los nitratos procedentes de las plantas puede ser incluso mayor que la de la carne para la mayoría de las personas. Las carnes procesadas no tienen fibra, vitaminas ni antioxidantes fitoquímicos, tienen un alto contenido en sodio, pueden contener mucha grasa y a menudo se fríen o se cocinan a una temperatura suficiente para degradar las proteínas en nitrosaminas, y normalmente no se consumen como parte de una dieta nutritiva y equilibrada con alto contenido en fibra, vitaminas, minerales y similares. Los nitratos son intermediarios y efectores clave en la señalización primaria de la vasculatura que es necesaria para que todos los mamíferos sobrevivan.[18]
Referencias
[editar]- ↑ Número CAS
- ↑ S. H. Baekeland "Några sidor af den kemiska industrien" (1914) Svensk Kemisk Tidskrift, p. 140.
- ↑ a b Friedrich Georg Wieck, Uppfinningarnas bok (1873, traducción sueca de Buch der Erfindungen), org/uppfinn/4/0485.html vol. 4, p. 473.
- ↑ Stephen R. Bown, La invención más condenable: dinamita, nitratos y la creación del mundo moderno, Macmillan, 2005, ISBN 0-312-32913-X, p. 157.
- ↑ Arias, Jaime (24 de julio de 2003). Sobre el origen del salitre, costa norte de Chile. Unión Internacional para la Investigación del Cuaternario. Archivado desde gsa/inqu/finalprogram/abstract_55601.htm el original el 4 de marzo de 2016. Consultado el 19 de agosto de 2018.
- ↑ Wyckoff, Ralph W. G. (1 de agosto de 1920). .149 «The Crystal Structure of Sodium Nitrate». Physical Review. doi:10.1103/PhysRev.16.149. Parámetro desconocido
|exemplar=ignorado (ayuda); Parámetro desconocido|pàgines=ignorado (ayuda); Parámetro desconocido|volum=ignorado (ayuda) - ↑ «mp-4531: NaNO3 (trigonal, R-3c, 167)». Consultado el 25 de abril de 2021.
- ↑ «Nitrato de sodio». PubChem.
- ↑ «John Straub's lecture notes». Consultado el 25 de abril de 2021.
- ↑ Kawai, Kota (2016). epj-n.org/articles/epjn/abs/2016/01/epjn150072/epjn150072.html «Análisis de la descomposición térmica de residuos líquidos de alto nivel simulados en tapa fría». EPJ Nuclear Sciences & Technologies 2: 44. ISSN 2491-9292. Parámetro desconocido
|lengua=ignorado (ayuda); Parámetro desconocido|nom4=ignorado (ayuda); Parámetro desconocido|cognom3=ignorado (ayuda); Parámetro desconocido|nom3=ignorado (ayuda); Parámetro desconocido|cognom2=ignorado (ayuda) - ↑ UK Food Standards Agency: «Actualmente los aditivos aprobados por la UE y sus números E». Consultado el 27 de octubre de 2011.
- ↑ «Listado del estado de los aditivos alimentarios Parte II». Consultado el 27 de octubre de 2011.
- ↑ Código de normas alimentarias de Australia Nueva Zelandacomlaw.gov.au/Details/F2011C00827 «Estándar 1.2.4 - Etiquetado de ingredientes». Consultado el 27 de octubre de 2011.
- ↑ De La Monte, SM; Neusner, A; Chu, J; Lawton, M (2009). «Las tendencias epidemiológicas sugieren fuertemente las exposiciones como agentes etiológicos en la patogénesis de la enfermedad de Alzheimer esporádica, diabetes mellitus y esteatohepatitis no alcohólica». Journal of Alzheimer's Disease 17 (3): 519-29. PMC 4551511. PMID 19363256.
- ↑ Jakszyn, Paula; Gonzalez, Carlos-Alberto (21 de julio de 2006). com/ecnis/handle/10146/25215 «La ingesta de nitrosaminas y alimentos relacionados y el riesgo de cáncer gástrico y de esófago: a systematic review of the epidemiological evidence». World Journal of Gastroenterology 12 (27): 4296-4303. PMC 4087738. PMID 16865769.
- ↑ Cross, AJ; Ferrucci, LM; Risch, A; Graubard, BI; Ward, MH; Park, Y; Hollenbeck, AR; Schatzkin, A et al. (2010). «Un gran estudio prospectivo sobre el consumo de carne y el riesgo de cáncer colorrectal: Una investigación de los posibles mecanismos subyacentes a esta asociación». Cancer Research 70 (6): 2406-14. PMC 2840051. PMID 20215514.
- ↑ "The Associations between Food, Nutrition and Physical Activity and the Risk of Colorectal Cancer" Archivado el 26 de julio de 2019 en Wayback Machine., World Cancer Research Fund (2010)
- ↑ Machha, Ajay; Schechter, Alan N. (Agosto 2011). «Nitritos y nitratos en la dieta: una revisión de los mecanismos potenciales de los beneficios cardiovasculares». European Journal of Nutrition 50 (5): 293-303. ISSN 1436-6207. PMC 3489477. PMID 21626413. doi:10.1007/s00394-011-0192-5.
Bibliografía
[editar]- Primo Yúfera, E., Carrasco Dorrien, J. M. (1973). Química Agrícola I. Editorial Alhambra.
- Archer, Donald G. (2000). «Thermodynamic properties of the NaNO3 + H2O system». Journal of Physical and Chemical Reference Data 29 (5): 1141-1156. Bibcode:2000JPCRD..29.1141A. ISSN 0047-2689. doi:10.1063/1.1329317.
- Barnum, Dennis (2003). «Some history of nitrates». Journal of Chemical Education 80 (12): 1393-. Bibcode:2003JChEd..80.1393B. doi:10.1021/ed080p1393.
- Mullin, J. W. (1997). Crystallization. Butterworth-Heinemann. ISBN 978-0-7506-3759-6.






