Acide perrhénique
| Acide perrhénique | ||
| ||
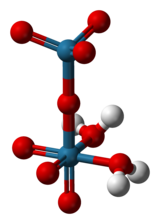 | ||
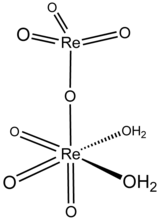
| Structure chimique de l'acide perrhénique. | ||
| Identification | ||
|---|---|---|
| Nom UICPA | Acide tétraoxorhénique(VII) | |
| Synonymes |
Oxyde de rhénium(VII) hydraté |
|
| No CAS | ||
| No ECHA | 100.033.968 | |
| No RTECS | TT4550000 | |
| SMILES | ||
| InChI | ||
| Apparence | Solide jaune pale | |
| Propriétés chimiques | ||
| Formule | H4O9Re2 (solide) HReO4 (gazeux) |
|
| Masse molaire[2] | 520,44 ± 0,005 g/mol H 0,77 %, O 27,67 %, Re 71,56 %, |
|
| pKa | -1.25[1] | |
| Propriétés physiques | ||
| T° ébullition | se sublime | |
| Solubilité | Soluble | |
| Point d’éclair | Ininflammable | |
| Précautions | ||
| Directive 67/548/EEC | ||
| Composés apparentés | ||
| Autres composés | ||
| Unités du SI et CNTP, sauf indication contraire. | ||
| modifier |
||
L'acide perrhénique est le composé chimique de formule Re2O7(OH2)2. Il est obtenu par évaporation de solutions aqueuses de Re2O7. Conventionnellement, l'acide perrhénique est considéré avoir la formule HReO4, et une espèce ayant cette formule se forme lorsque l'oxyde de rhénium(VII) se sublime en présence d'eau ou de vapeur[3]. Lorsqu'une solution de Re2O7 est conservée pendant plusieurs mois, elle se décompose et des cristaux de HReO4·H2O se forment, qui contiennent des ions ReO4− tétraédriques[4]. Pour la plupart des usages, l'acide perrhénique et l'oxyde de rhénium(VII) sont interchangeables. Le rhénium peut être dissout dans l'acide nitrique ou l'acide sulfurique concentré pour produire l'acide perrhénique.
Propriétés
[modifier | modifier le code]La structure de l'acide perrhénique solide est [O3Re-O-ReO3(H2O)2][5]. Cette espèce est un exemple rare d'un oxyde métallique coordonné à l'eau ; le plus souvent les espèces métal-oxo-aquo sont instables vis-à-vis des hydroxydes correspondants :
- M(O)(H2O) → M(OH)2
Les deux atomes de rhénium ont des géométries de liaison différentes, l'un étant tétraédrique et l'autre octaédrique, les ligands eau étant liés au dernier. L'acide perrhénique gazeux est tétraédrique, comme le suggère sa formule HReO4.
Réactions
[modifier | modifier le code]L'acide perrhénique ou l'oxyde anhydre correspondant Re2O7 sont convertis en heptasulfure de dirhénium par traitement avec le sulfure d'hydrogène :
- Re2O7 + 7 H2S → Re2S7 + 7 H2O
L'heptasulfure, qui a une structure complexe[6], catalyse l'hydrogénation des doubles liaisons et est utile car il tolère les composés soufrés, qui empoisonnent les catalyseurs en métaux nobles. Re2S7 catalyse également la réduction de l'oxyde nitrique en N2O.
En présence de HCl, l'acide perrhénique subit une réduction en présence de thioéthers et de phosphines tertiaires pour donner des complexes Re(V) de formule ReOCl3L2[7].
L'acide perrhénique combiné avec le platine sur un support forme un catalyseur d'hydrogénation et d'hydrocrackage utile pour l'industrie pétrolière[8]. Par exemple, la silice imprégnée d'une solution d'acide perrhénique est réduite par l'hydrogène à 500 °C[réf. nécessaire]. Ce catalyseur est utilisé pour la déshydrogénation des alcools et provoque également la décomposition de l'ammoniac.
Catalyse
[modifier | modifier le code]L'acide perrhénique est le précurseur d'une variété de catalyseurs homogènes, certains d'entre eux sont prometteurs dans des applications de niche qui peuvent justifier le coût élevé du rhénium. En combinaison avec les arsines tertiaires, l'acide perrhénique fournit un catalyseur pour l'époxydation des alcènes avec le peroxyde d'hydrogène[9]. L'acide perrhénique catalyse la déshydration des oximes en nitriles[10].
Autres utilisations
[modifier | modifier le code]L'acide perrhénique est également utilisé dans la fabrication de cibles de rayons X[11],[12].
Voir aussi
[modifier | modifier le code]Articles connexes
[modifier | modifier le code]Notes et références
[modifier | modifier le code]- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Perrhenic acid » (voir la liste des auteurs).
- http://www.iupac.org/publications/pac/1998/pdf/7002x0355.pdf.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Glemser, O., Müller, A. et Schwarzkopf, H., « Gasförmige Hydroxide. IX. Über ein Gasförmiges Hydroxid des Rheniums », Zeitschrift für anorganische und allgemeine Chemie, vol. 334, , p. 21–26 (DOI 10.1002/zaac.19643340105).
- (en) Norman N. Greenwood et Alan Earnshaw, Chemistry of the Elements, Butterworth-Heinemann (en), , 2e éd. (ISBN 0080379419).
- Beyer, H.; Glemser, O.; Krebs, B. "Dirhenium Dihydratoheptoxide Re2O7(OH2)2 - New Type of Water Bonding in an Aquoxide" Angewandte Chemie, International Edition English 1968, Volume 7, Pages 295 - 296. DOI 10.1002/anie.196802951.
- (en) Schwarz, D. E., Frenkel, A. I., Nuzzo, R. G., Rauchfuss, T. B. et Vairavamurthy, A., « Electrosynthesis of ReS4. XAS Analysis of ReS2, Re2S7, and ReS4 », Chemistry of Materials, vol. 16, , p. 151–158 (DOI 10.1021/cm034467v).
- (en) Parshall, G. W., L. W. Shive et F. A. Cotton, « Phosphine Complexes of Rhenium », Inorganic Syntheses, vol. 17, , p. 110–112 (DOI 10.1002/9780470132487.ch31).
- Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. (ISBN 0-12-352651-5).
- (en) van Vliet, M. C. A., Arends, I. W. C. E. et Sheldon, R. A., « Rhenium Catalysed Epoxidations with Hydrogen Peroxide: Tertiary Arsines as Effective Cocatalysts », J. Chem. Soc., Perkin Trans. 1, no 3, , p. 377–80 (DOI 10.1039/a907975k).
- (en) Ishihara, K., Furuya, Y. et Yamamoto, H., « Rhenium(VII) Oxo Complexes as Extremely Active Catalysts in the Dehydration of Primary Amides and Aldoximes to Nitriles », Angewandte Chemie International Edition, vol. 41, no 16, , p. 2983–2986 (DOI 10.1002/1521-3773(20020816)41:16<2983::AID-ANIE2983>3.0.CO;2-X).
- « ? »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?), .
- Générateur de rayons X.

