Oxyde de terbium(III)
| Oxyde de terbium(III) | |
| |
| __ Tb3+ __ O2− | |
| Identification | |
|---|---|
| Synonymes |
sesquioxyde de terbium |
| No CAS | [1] |
| No ECHA | 100.031.668 |
| No CE | 234-849-5 |
| PubChem | 159410 |
| SMILES | |
| InChI | |
| Apparence | poudre ou cristaux cubiques, blancs[1] |
| Propriétés chimiques | |
| Formule | Tb2O3 |
| Masse molaire[2] | 365,848 9 ± 0,000 9 g/mol O 13,12 %, Tb 86,88 %, |
| Propriétés physiques | |
| T° fusion | 2 303 °C[1] |
| Masse volumique | 7,91 g·cm-3[1] |
| Cristallographie | |
| Système cristallin | cubique |
| Symbole de Pearson | |
| Classe cristalline ou groupe d’espace | Ia3 (no 206) |
| Précautions | |
| SGH[3] | |
| H315, H319, H335, P261 et P305+P351+P338 |
|
| Composés apparentés | |
| Autres cations | Oxyde de scandium Oxyde d'yttrium(III) Oxyde de lanthane Oxyde de cérium(III) Oxyde de praséodyme(III) Oxyde de néodyme(III) Oxyde de samarium(III) Oxyde d'europium(III) Oxyde de gadolinium Oxyde de dysprosium(III) Oxyde d'holmium(III) Oxyde d'erbium(III) Oxyde de thulium(III) Oxyde d'ytterbium(III) Oxyde de lutécium(III) |
| Autres anions | Chlorure de terbium(III) |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
L'oxyde de terbium(III) ou sesquioxyde de terbium est un oxyde du lanthanide terbium de formule Tb2O3.
Synthèse
[modifier | modifier le code]La réaction directe du terbium avec l'oxygène ne peut fournir Tb2O3 mais donne l'oxyde de terbium(III,IV) brun, Tb4O7. Tb2O3 est préparé par réduction de Tb4O7 sous atmosphère d'hydrogène à 1300 °C pendant 24 heures[4] :
Propriétés
[modifier | modifier le code]Il s'agit d'un semi-conducteur de type p lorsque dopé avec du calcium[5].
C'est un oxyde basique qui se dissout facilement dans des solutions d'acides dilués et forme des solutions de sels de terbium(III) presque incolores :
- Tb2O3 + 6 H+ → 2 Tb3+ + 3 H2O.
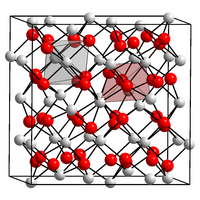
Structure
[modifier | modifier le code]Sa structure cristalline est cubique centré, groupe d'espace Ia3 (no 206)[4] avec le paramètre de maille a = 1072,81 ± 0,05 pm[6] et Z, nombre d'unités par maille égal à 16 ce qui donne un volume de maille V de 1,235 nm3 et une masse volumique de 7,869 g.cm-3[4].
Tous les oxydes de terre rare du samarium au lutécium, comme beaucoup d'autres composés M2O3 ont ce type de structure dite de type C- (cubique). Le C-Tb2O3 se transforme en une structure monoclinique dite de type B- vers 1 875 °C, avec les paramètres de maille, a = 1404 pm, b = 345,1 pm, c = 872,5 pm et β = 100,06°. Vers approximativement 2 150 °C, une structure hexagonale dite de type A- est observée[4].
Notes et références
[modifier | modifier le code]- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Terbium(III) oxide » (voir la liste des auteurs).
- (en) William M. Haynes, CRC Handbook of Chemistry and Physics, vol. 97, CRC Press/Taylor and Francis, , 2652 p. (ISBN 1498754287), « Physical Constants of Inorganic Compounds », p. 813 (4-94).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée « Terbium(III) oxide » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 9 août 2017 (JavaScript nécessaire).
- (en) G. J. McCarthy, « Crystal data on C-type terbium sesquioxide (Tb2O3) », Journal of Applied Crystallography, vol. 4, no 5, , p. 399–400 (DOI 10.1107/S0021889871007295).
- (en) Reidar Haugsrud, Yngve Larring et Truls Norby, « Proton conductivity of Ca-doped Tb2O3 », Elsevier B.V., vol. 176, nos 39–40, , p. 2957–2961 (DOI 10.1016/j.ssi.2005.09.030).
- N. C. Baenzinger, H. A. Eick, H. S. Schuldt, L. Eyring, Terbium Oxides. III. X-Ray Diffraction Studies of Several Stable Phases, Journal of the American Chemical Society, 1961, vol. 83(10), pp. 2219-2223. DOI 10.1021/ja01471a001.





