Enllaz covalente
Un enllaz covalente ente dos átomos produzse cuando estos átomos xúnense, p'algamar l'octeto estable, compartiendo electrones del últimu nivel[1] (sacante'l hidróxenu qu'algama la estabilidá cuando tien 2 electrones). La diferencia d'electronegatividá ente los átomos nun ye lo suficientemente grande como por que se produza una unión de tipu iónica. Por que un enllaz covalente xenérese ye necesariu que la diferencia de electronegatividá ente átomos seya menor a 1,7.[2]
| Enllaz covalente | |
|---|---|
| enllaz químicu | |
 | |

D'esta forma, los dos átomos comparten unu o más Par d'electrones pares electrónicos nun nuevu tipu d'orbital, denomináu orbital molecular. Los enllaces covalentes producir ente átomos d'un mesmu elementu non metal, ente distintos non metales y ente un non metal y l'hidróxenu.[3][4]
Cuando átomos distintos de non metales xunir nuna forma covalente, unu d'ellos va resultar más electronegativu que l'otru, polo que va tender a atraer la nube electrónica del enllaz escontra'l so nucleu, xenerando un dipolo llétricu.[5] Esta polarización dexa que les molécules del mesmu compuestu atraer ente sigo por fuercies electrostáticas de distinta intensidá.
Otra manera, cuando átomos d'un mesmu elementu non metálicu xúnense covalentemente, la so diferencia de electronegatividá ye cero y nun se crean dipolos. Les molécules ente sigo tienen práuticamente una atraición nula.
En resume, nun enllaz iónicu, produzse la tresferencia d'electrones d'un átomu a otru y nel enllaz covalente, los electrones d'enllaz son compartíos por dambos átomos. Nel enllaz covalente, los dos átomos non metálicos comparten unu o más electrones, esto ye, xúnense al traviés de los sos electrones nel postreru orbital, que depende del númberu atómicu en cuestión. Ente los dos átomos pueden compartise unu, dos o trés pares d'electrones, lo cual va dar llugar a la formación d'un enllaz simple, doble o triple respeutivamente. Na estructura de Lewis, estos enllaces pueden representase per una pequeñu llinia ente los átomos.
Historia
editarEl términu covalencia en rellación a la unión foi utilizada per primer vegada en 1919 por Irving Langmuir n'artículu del Journal of the American Chemical Society tituláu «The Arrangement of Electrons in Atoms and Molecules» (La distribución d'electrones n'átomos y molécules). N'éste, Langmuir escribió: «vamos designar col términu covalencia al númberu de pares d'electrones qu'un determináu átomu comparte colos sos vecinos».[6]
La idea de la unión covalente puede remontase dellos años antes hasta Gilbert N. Lewis, quien en 1916 describió l'intercambiu de pares d'electrones ente los átomos.[7] Introdució la notación de Lewis o notación de puntos d'electrones o estructura de puntos de Lewis, nel que la valencia de los electrones (los de la capa esterior) representar en forma de puntos en redol a los símbolos atómicos. Los pares d'electrones alcontraos ente átomos representen enllaces covalentes. Múltiples pareyes representen enllaces múltiples, tales como enllaces dobles y enllaces triples. Una forma alternativa de representación, que nun s'amuesa equí, tien los pares d'electrones de formación d'enllaces representaos como llinies sólides.
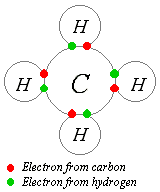
Lewis propunxo qu'un átomu forma abondos enllaces covalentes pa formar una capa electrónica esterior completa (o zarrada). Na diagrama del metanu que s'amuesa equí, l'átomu de carbonu tien una valencia de cuatro y ta, poro, arrodiáu per ocho electrones (la regla del octeto), cuatro del carbonu mesmu y cuatro de los hidróxenos xuníos a él. Cada hidróxenu tien una valencia d'unu y ta arrodiáu per dos electrones (una regla del dueto), el so propiu electrón más unu del carbonu. El númberu d'electrones correspuenden a capes completes na teoría cuántica del átomu; la capa esterior d'un átomu de carbonu ye la capa n = 2, con capacidá pa ocho electrones, ente que la capa esterior (y única) d'un átomu d'hidróxenu ye la capa n = 1, con capacidá pa solu dos.
Magar la idea de los pares d'electrones compartíos apurre una imaxe cualitativa efectiva de la unión covalente, ye necesaria la mecánica cuántica pa entender la naturaleza d'estes uniones y predicir les estructures y propiedaes de les molécules simples. Walter Heitler y Fritz London dieron la primer esplicación con ésitu d'un enllaz químicu aplicando la mecánica cuántica, en concretu del hidróxenu molecular, en 1927.[8] El so trabayu basar nel modelu d'enllaz de valencia, qu'asume qu'un enllaz químicu fórmase cuando hai una bona coincidencia ente los orbitales atómicos de los átomos participantes.
Sábese qu'estos orbitales atómicos tienen rellaciones angulares específiques ente ellos, y polo tanto'l modelu d'enllaz de valencia pueden predicir con ésitu los ángulos d'enllaz reparaos en molécules simples.
Sicasí la teoría del enllaz covalente o tamién conocíu como la idea de la compartición d'electrones, que ta basáu nel átomu cúbicu, enfrentar a delles dificultaes conceptuales, una y bones esta teoría tuvo como competencia al modelu del enllaz iónicu. A pesar d'esta rivalidá d'estos dos Teoríes, la teoría del enllaz covalente foi aceptada hasta 1920. M.Niaz y M.A.Rodríguez menten nel so testu Historia y filosofía de les ciencies: necesidá de la so incorporación nos testos universitarios de ciencies que Lewis reconoz que la estructura cúbica nun puede representar el triple enllaz y suxer reemplazalo pol átomu tetraédricu. Lewis asumió per munchos años que, si los electrones tán pareados nel átomu magnéticamente, ye fácil entender cómo dos electrones non pareados n'átomos distintos pueden acoplase magnéticamente y formar l'enllaz non polar.
Tipos de sustancies covalentes
editarEsisten dos tipos de sustancies covalentes:
Sustancies covalentes moleculares: los enllaces covalentes formen molécules que tienen les siguientes propiedaes:[9][10]
- Temperatures de fusión y ebullición baxes.
- En condiciones normales de presión y temperatura (25 °C aprox.) pueden ser sólidos, líquidos o gaseosos.
- Son blandos n'estáu sólidu.
- Son aislantes de la corriente llétrica y el calor.
- Solubilidá: les molécules polares son solubles en disolventes polares y les apolares son solubles en disolventes apolares (lo asemeyáu esllee a lo asemeyáu).
- Exemplos: dióxidu de carbonu, bencenu, osíxenu, nitróxenu.
Redes o sustancies covalentes reticulares: Amás, les sustancies covalentes formen redes cristalines d'un númberu indefiníu d'átomos, asemeyaos a los compuestos iónicos, que tienen estes propiedaes:[10]
- Elevaes temperatures de fusión y ebullición.
- Son sólidos en Condiciones Normales.
- Son sustancies bien dures.
- Son aislantes (sacante'l grafitu).
- Son insolubles.
- Exemplos: cuarzu, diamante.
Definición del enllaz covalente
editarConsidérense átomos d'hidróxenu, a midida que avérense ente sigo, van faciéndose notar les fuercies qu'atraen a cada electrón al nucleu del otru átomu, hasta que diches fuercies d'atraición llegar a compensar cola repulsión que los electrones sienten ente sigo. Nesi puntu, la molécula presenta la configuración más estable.
Lo qu'asocedió ye que los orbitales de dambos electrones asolapáronse, de cuenta qu'agora ye imposible estremar a qué átomu pertenez cada unu de los electrones.
Según los químicos S. Seese y G. William Daub, na molécula d'hidróxenu como en toles sustancies covalentes deber de tomar cuatro aspectos:
Primero: les propiedaes de los átomos individuales ensin combinar son bien distintos a les propiedaes de les molécules. Por ello cuando s'escribe la fórmula química del hidróxenu tien d'escribise como H2, por cuenta de que ye una molécula diatómica.
Segundu: los dos nucleos positivos atraen a los dos electrones col fin de producir una molécula más estable que la de los átomos separaos, en consecuencia forma un enllaz y con ello resulta una molécula más estable a comparanza de l'anterior. Por cuenta de l'atraición qu'exercen los nucleos sobre los dos electrones permédiase la repulsión qu'hai ente ellos, por cuenta de esto ye mayor la probabilidá d'atopar electrones en dalgún llugar asitiáu ente dos nucleos.
Terceru: la distancia ente los nucleos ye tal que les orbitales 1s tienen el máximu traslape, nel casu de la molécula d'hidróxenu, la distancia ente los nucleos ye aproximao de 0.74 Å. Otra manera, la distancia qu'esiste ente dos átomos que se xunen en forma covalente llámase llargor d'enllaz.
Cuartu: pa "romper" los enllaces covalentes qu'hai en 1.0 g d'hidróxenu gaseosu y pa formar los átomos d'hidróxenu precísense 52. 0 kcal.[11]
Sicasí, cuando los átomos son distintos, los electrones compartíos nun van ser atraíos por igual, de cuenta que estos van tender a averase escontra l'átomu más electronegativu, esto ye, aquel que tenga una mayor apetencia d'electrones. Esti fenómenu denominar polaridá (los átomos con mayor electronegatividá llogren una polaridá más negativa, atrayendo los electrones compartíos escontra'l so nucleu), y resulta nun desplazamientu de les cargues dientro de la molécula.
Podría dicise que al átomu más electronegativu al cual, nun-y gusta compartir los sos electrones colos demás átomos, y nel casu más estremu, va deseyar que l'electrón sía-y vencíu ensin condiciones formándose entós un enllaz iónicu, d'ende que se diga que los enllaces covalentes polares tienen, en dalguna midida, calter iónicu.
Cuando la diferencia de electronegatividades ye nula (dos átomos iguales), l'enllaz formáu va ser covalente puru; pa una diferencia de electronegatividades de 1,9 el calter iónicu algama yá'l 35%, y pa una diferencia de 3, va ser del 49,5%.
Con éses pa diferencies de electronegatividades mayores de 1,7 l'enllaz va adquirir mayor calter iónicu.
Ente l'osíxenu o flúor y los elementos de los grupos 1 y 2, esta diferencia va ser máxima y el so calter iónicu tamién.
Cuando la diferencia tien un valor de 0 a 1,7 va ser el calter covalente el que predomine, como ye'l casu del enllaz C-H. Sicasí, según el químicu Raymond Chang, esta diferencia de electronegatividá ente los átomos tien de ser de 2,0 o mayor por que el enllaz seya consideráu iónicu (Chang, 371).
Dependiendo de la diferencia de electronegatividá, l'enllaz covalente pue ser clasificáu en covalente polar y covalente puru o apolar. Si la diferencia de electronegatividá ta ente 0,4 y 1,7 ye un enllaz covalente polar, y si ye inferior a 0,4 ye covalente apolar.
Enllaz covalente polar
editarConsiste na formación d'un enllaz ente átomos de distintos elementos, y la diferencia de la electronegatividá tien de ser mayor de 0,5. Nesti enllaz, los electrones son atraíos fundamentalmente pol nucleu del átomu más electronegativu, xenerando molécules que la so nube electrónica va presentar una zona con mayor densidá de carga negativa y otra con mayor densidá de carga positiva (dipolo).
Enllaz covalente apolar
editarFormar ente átomos iguales y la diferencia de electronegatividá tien de ser cero o bien menguada (menor que 0,4). Nesti enllaz, los electrones son atraíos por dambos nucleu cola mesma intensidá, xenerando molécules que la so nube electrónica ye uniforme.
width="100 px" style="background:
|
width="80 px" style="background:
|
|---|---|
| Etanu | style="background:
|
| Tolueno | Fenol |
| isobutano | Acetona |
| n-Pentano | Acedu Propinoico |
Distintos tipos d'enllaces covalentes
editar- Enllaz simple: ye un par electrónicu compartíu formáu por un electrón perteneciente al últimu nivel d'enerxía de cada átomu y represéntase con una llinia. Exemplos: H-H, Cl-Cl
- Enllaz doble: Formáu por dos pares electrónicos compartíos, ye dicir por dos electrones pertenecientes al últimu nivel d'enerxía de cada átomu y represéntase con dos llinies paraleles. Exemplu: O=O
Enllaz covalente doble. - Enllaz triple: Formáu por trés pares electrónicos compartíos, ye dicir por trés electrones pertenecientes al últimu nivel d'enerxía de cada átomu y represéntase con tres llinies paraleles. Exemplu: N≡N
- Enllaz covalente dativu o de coordinación: Ye un par electrónicu compartíu por dos átomos pero ambos electrones son apurríos pol mesmu átomu. Suelse representar con una flecha (→).
Un exemplu d'una especie química que tien un enllaz coordináu, que ye'l ion amoniu (NH41+). El Ion amoniu ta constituyíu por un protón y amoniacu. Los compuestos nos que s'atopa un enllaz coordináu conocer col nome de compuestos de coordinación. Los Compuestos de coordinación o tamién denominaos complexos, que na so mayoría de los casos tán xuníos a dellos aniones circundantes conocíos como ligandos.
Ver tamién
editarReferencies
editar- ↑ Enllaz covalente en Google Books
- ↑ Quimica 2 (en castellanu). Ediciones Estragal. ISBN 9789685607209. Consultáu'l 2018-02-02.
- ↑ Picazo, Susana María López (2009). elementu+non+metal+y+ente+distintos+elementos+non+metales&hl=es&sa=X&ved=0ahUKEwjT5rSa2IfZAhWR6lMKHbtcC84Q6AEIJzAA#v=onepage&q=covalente%20mesmu%20elementu%20non%20metal%20y%20ente%20distintos%20elementos%20non%20metales&f=false Química. Pruebes d'accesu a la universidá pa mayores de 25 años (en castellanu). Cultivalibros. ISBN 9788499231099. Consultáu'l 2018-02-02.
- ↑ en+una forma covalente&hl=es&sa=X&ved=0ahUKEwjv6K7H2IfZAhVSnRQKHcFzAOUQ6AEILDAB#v=onepage&q=non%20metales%20se%20xunen%20en%20una%20forma%20covalente&f=false Química II Segundu Semestre Tacaná (en castellanu). IGER. ISBN 9789929804623. Consultáu'l 2018-02-02.
- ↑ (2004) nube+electr%C3%B3nica+del enllaz+escontra+el so+n%C3%BAcleo&hl=es&sa=X&ved=0ahUKEwjoxom22YfZAhUJShQKHbRdApwQ6AEIJzAA#v=onepage&q=atraer%20la%20nube%20electr%C3%B3nica%20d'el%20enllaz%20escontra%20el so%20n%C3%BAcleo&f=false La Quimica en Les tos Manes (en castellanu). UNAM. ISBN 9789703212231. Consultáu'l 2018-02-02.
- ↑ "we shall denote by the term covalence the number of pairs of electrons that a given atom shares with its neighbors." Langmuir, Irving (1 de xunu de 1919). «The Arrangement of Electrons in Atoms and Molecules». Journal of the American Chemical Society 41 (6): páxs. 868-934. doi:.
- ↑ Lewis, Gilbert N. (1 d'abril de 1916). «The atom and the molecule». Journal of the American Chemical Society 38 (4): páxs. 762-785. doi:.
- ↑ W. Heitler and F. London, Zeitschrift für Physik, vol. 44, p. 455 (1927). English translation in Hettema, H. (2000). Quantum chemistry: classic scientific papers. World Scientific, páx. 140–. ISBN 978-981-02-2771-5. Consultáu'l 5 de febreru de 2012.
- ↑ «Compuestos covalentes moleculares». Consultáu'l 2018-02-02.
- ↑ 10,0 10,1 Antón, Juan Luis; Andrés, Dulce María (2015-06). Física y Química 3º ESO (LOMCE) (en castellanu). Editex. ISBN 9788490785270. Consultáu'l 2018-02-02.
- ↑ Franchini, William S. Seese, G. William Daub ; traducción, Ma. Cristina Regueru Espinosa ; revisión técnica, Ma. Cristina Sanginés (1989) Química, 1a ed. n'español., Méxicu: Prentice-Hall Hispanoamericanu. ISBN 968-880-167-4.
Bibliografía
editar- Introducción al enllaz químicu. páxs. 2-27.
- Franchini, William S. Seese, G. William Daub ; traducción, Ma. Cristina Regueru Espinosa ; revisión técnica, Ma. Cristina Sanginés (1989) Química, 1a ed. n'español., Méxicu: Prentice-Hall Hispanoamericanu. ISBN 968-880-167-4.
- Escudero P., Lauzurica M., Pascual R., Pastor J.M. (1999). «10», Físicu- Química. Estomba 44, Buenos Aires, Arxentina: Santillana, páx. 133, 138. ISBN 950-46-0181-2.
Enllaces esternos
editar- Esplicaciones completes en videu sobre l'enllaz covalente. (enllaz rotu disponible n'Internet Archive; ver l'historial y la última versión).