Acide acrylique
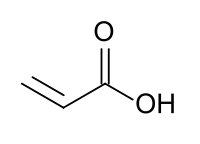
L'acide acrylique ou acide acroléique ou acide prop-2-énoïque est un composé organique de formule brute C3H4O2 et de formule semi-développée CH2=CHCOOH. C'est un acide carboxylique et un alcène vinylique, et se présente comme un liquide incolore à l'odeur âcre.
| Acide acrylique | ||
| ||
 | ||
| Identification | ||
|---|---|---|
| Nom UICPA | Acide propénoïque | |
| Synonymes |
Acide propénique |
|
| No CAS | ||
| No ECHA | 100.001.071 | |
| No CE | 201-177-9 | |
| Apparence | liquide incolore, d'odeur caractéristique[1]. | |
| Propriétés chimiques | ||
| Formule | C3H4O2 [Isomères] |
|
| Masse molaire[2] | 72,062 7 ± 0,003 3 g/mol C 50 %, H 5,59 %, O 44,4 %, |
|
| pKa | 4,25 | |
| Propriétés physiques | ||
| T° fusion | 14 °C[1] | |
| T° ébullition | 141 °C[1] | |
| Solubilité | dans l'eau : miscible[1] | |
| Paramètre de solubilité δ | 24,6 MPa1/2 (25 °C)[3] | |
| Masse volumique | 1,05 g·cm-3[1] | |
| T° d'auto-inflammation | 360 °C[1] | |
| Point d’éclair | 54 °C (coupelle fermée)[1] | |
| Limites d’explosivité dans l’air | 2,4–8 %vol[1] | |
| Pression de vapeur saturante | à 20 °C : 413 Pa[1] | |
| Point critique | 56,7 bar, 341,85 °C [4] | |
| Thermochimie | ||
| ΔfH0gaz | -330 kJ/mol | |
| ΔfH0liquide | -384 kJ/mol | |
| Cp | 144 J/mol.K
|
|
| Propriétés électroniques | ||
| 1re énergie d'ionisation | 10,60 eV (gaz)[6] | |
| Cristallographie | ||
| Classe cristalline ou groupe d’espace | Ibam [7] | |
| Paramètres de maille | a = 9,952 Å b = 11,767 Å |
|
| Volume | 726,75 Å3 [7] | |
| Précautions | ||
| SGH[9] | ||
| H226, H302, H312, H314, H332 et H400 |
||
| SIMDUT[10] | ||
Produit non classé |
||
| NFPA 704 | ||
| Transport | ||
| Classification du CIRC | ||
| Groupe 3 : Inclassable quant à sa cancérogénicité pour l'Homme[8] | ||
| Écotoxicologie | ||
| LogP | 0,36 (estimé)[1] | |
| Seuil de l’odorat | bas : 0,09 ppm haut : 1 ppm[11] |
|
| Unités du SI et CNTP, sauf indication contraire. | ||
| modifier |
||
Utilisation
modifierL'acide acrylique et ses esters, les acrylates, sont utilisés dans la fabrication de matières plastiques, dans les peintures acryliques et dans divers autres polyacryliques qui ont de multiples usages. La demande d'acide acrylique a progressivement augmenté, passant de 3,2 millions de tonnes (2005) à env. 5,57 millions de tonnes (2014).
Production
modifierL'acide acrylique est produit à partir du propylène, un sous-produit issu du raffinage du pétrole. Dans les années 90, on a utilisé un procédé d'oxydation au propane en une seule étape, en utilisant des compositions catalytiques compliquées (c'est-à-dire des Mo-W-Te-Sn-Co-O et Nb-W- Co-Ni-Bi- Fe-Mn-Si-Zr-O). Actuellement, un procédé en deux étapes est utilisé pour la production d'acide acrylique. Dans la première étape, le propène est oxydé en acroléine en utilisant des catalyseurs au molybdate de bismuth. Dans la deuxième étape, l'acroléine est davantage oxydée en acide acrylique avec catalyseurs à base de molybdène et de vanadium. En raison du fait que le propane est une matière première significativement moins chère que le propylène, l'oxydation sélective en une étape du propane en acide acrylique fait actuellement l'objet de recherches intensives[12]. Un catalyseur prometteur est constitué des Mo, V, Te et Nb, avec une structure cristalline spécifique[13]. La structure en masse de ce catalyseur est stable sous une composition de gaz oxydant et réducteur. D'autre part, la composition de surface et les propriétés catalytiques changent dynamiquement avec la teneur en oxygène et en vapeur du gaz réactif[14],[15].
L'hydrolyse de l'acrylonitrile conduit à l'acide acrylique dont les esters sont les monomères de la synthèse des résines acryliques.
la synthèse d'acide acrylique à partir de l'acétylène s'effectue en présence de nickel carbonyle:
4C2H2 + Ni(CO)4 + 4H2O + 2HCl → 4 CH2 = CH - COOH + NiCl2 + H2.
Voir aussi
modifierRéférences
modifier- ACIDE ACRYLIQUE, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) James E. Mark, Physical Properties of Polymer Handbook, Springer, , 2e éd., 1076 p. (ISBN 0387690026, lire en ligne), p. 294
- « Properties of Various Gases »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?), sur flexwareinc.com (consulté le ).
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 1, Huston, Texas, Gulf Pub. Co., (ISBN 0-88415-857-8)
- (en) David R. Lide, Handbook of chemistry and physics, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205
- « Acroleic acid », sur www.reciprocalnet.org (consulté le ).
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 3 : Inclassables quant à leur cancérogénicité pour l'Homme »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?), sur monographs.iarc.fr, CIRC, (consulté le ).
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- « Acide acrylique » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- « Acrylic acid », sur hazmap.nlm.nih.gov (consulté le ).
- (en) Kinetic studies of propane oxidation on Mo and V based mixed oxide catalysts (Thése de doctorat), (lire en ligne)
- (en) « Multifunctionality of Crystalline MoV(TeNb) M1 Oxide Catalysts in Selective Oxidation of Propane and Benzyl Alcohol », ACS Catalysis, vol. 3, no 6, , p. 1103-1113 (DOI 10.1021/cs400010q, lire en ligne)
- (en) « Surface chemistry of phase-pure M1 MoVTeNb oxide during operation in selective oxidation of propane to acrylic acid », Journal of Catalysis, vol. 285, , p. 48-60 (DOI 10.1016/j.jcat.2011.09.012, lire en ligne)
- (en) « The reaction network in propane oxidation over phase-pure MoVTeNb M1 oxide catalysts », Journal of Catalysis, vol. 311, , p. 369-385 (DOI 10.1016/j.jcat.2013.12.008, lire en ligne)









