Ugljena kiselina
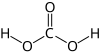
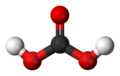
Ugljična kiselina (karbonatna kiselina, (O=C(OH)2), H2CO3) slaba je anorganska kiselina. Nastaje otapanjem ugljikova(IV) oksida u vodi, no vrlo mala količina CO2 izreagira sa vodom, jer se čak 99 % CO2 u vodi nalazi u molekularnom stanju. U industriji se karbonatna kiselina koristi za proizvodnju pjenušavih (gaziranih) pića jer pićima daje kiselkast osvježavajuć okus, a nije opasna za čovjeka. Karbonatna kiselina se spontano raspada na CO2 i H2O.
| Ugljena kiselina | |||
|---|---|---|---|
 |
 | ||
| IUPAC ime |
| ||
| Drugi nazivi | Rastvor ugljen dioksida; Dihidrogen karbonat; vazdušna kiselina | ||
| Identifikacija | |||
| CAS registarski broj | 463-79-6 | ||
| ChemSpider[1] | 747 | ||
| KEGG[2] | |||
| ChEBI | 28976 | ||
| ChEMBL[3] | CHEMBL1161632 | ||
| Jmol-3D slike | Slika 1 | ||
| |||
| |||
| Svojstva | |||
| Molekulska formula | H2CO3 | ||
| Molarna masa | 62.03 g/mol | ||
| Gustina | 1.0 g/cm3 (rastvor) | ||
| Tačka topljenja |
n/a | ||
| Rastvorljivost u vodi | postoji samo ur rastvoru | ||
| pKa | 6.352 (pKa1) | ||
|
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje (25 °C, 100 kPa) materijala | |||
| Infobox references | |||
- CO2 + H2O → H2CO3
Iako se spojevi koji imaju dvije hidroksilne grupe na istom ugljikovom atomu mogu rijetko izolirati u čistu stanju, izgleda da oni mogu postojati u vodenoj otopini. Za takav primjer u kemiji je najbolja ugljična kiselina, koja se u vodenoj otopini ponaša kao dvobazna kiselina, ali se može izolirati samo u obliku svojih soli ili estera, ili kao anhidrid (tj. ugljikov dioksid).
Karbonatna kiselina disocira otapanjem u vodi i stvara dvije vrste iona; hidrogenkarbonatni i karbonatni ion.
- H2CO3 + H2O → HCO3- + H3O+
- HCO3- + H2O → CO32- + H3O+
Pa tako stvara karbonatne (kalcijev karbonat, natrijev karbonat ...) i hidrogenkarbonatne (natrijev hidrogenkarbonat, kalcijev hidrogenkarbonat ...) soli.
Kalcijev karbonat (CaCO3) ili vapnenac najvažniji je karbonat koji izgrađuje mnoge planinske lance (Dinara, Velebit, Alpe...), a i različiti organizmi od njega grade svoje ljušturice, kućice i oklope jer je vapnenac gotovo netopljiv u vodi. Često se zna i pojavljivati sa magnezijevim karbonatom u obliku dolomita (CaMg(CO3)2).
Stvaranje špiljskih ukrasa
urediVoda koja isparava u vapnenačkim špiljama spaja se sa ugljikovim dioksidom iz zraka te nastaje karbonatna kiselina. Karbonatna kiselina potom otapa vapnenac i stvara sa njim u vodi topljivi kalcijev hidrogenkarbonat (Ca(HCO3)2):
- CaCO3 + H2O + CO2 → Ca(HCO3)2
Isparavanjem vode iz zasićene otopine kalcijeva hidrogenkarbonata oslobađa se ugljikov dioksid a izlučuje se netopivi kalcijev karbonat koji stvara stalaktite, stalagmite i stalagmate.
Natrijev hidrogenkarbonat (NaHCO3) može se kupiti u svakoj trgovini pod nazivom soda bikarbona ili natrijev bikarbonat, a služi pri izradi tijesta, za ublažavanje želudačn kiseline (antacidno sredstvo) tj. žgaravice itd. U industriji sodu bikarbonu možemo pronaći u šumećim tabletama koja reagira sa kiselinama u tableti i oslobađa CO2 koji šumi i pjeni. U našem želucu nalizi se 0,5 %-tna klorovodična kiselina pa tako natrijev hidrogenkarbonat s njom u reakciji daje natrijev klorid tj. kuhinjsku sol.
- NaHCO3 + HCl → NaCl + H2O + CO2
U antacidnim sredstima tj. sredstvima koji suzbijaju jaku kiselinu mogu se naći i magnezijev karbonat (MgCO3) i magnezijev hidrogenkarbonat (Mg(HCO3)2).
U prirodi osim kalcijeva možemo pronaći i željezov(II) karbonat , a nalazimo ga u mineralu sideritu (FeCO3), vrijednom mineralu željeza.
Svi karbonatni spojevi mogu se dokazati s nekom kiselinom koja je jača od ugljične pa zato je iz njezinih spojeva istiskuje u obliku vode i dioksida, a prisustvo ugljikova dioksida može se dokazati vapnenom vodom tj. bistom otopinom kalcijeva hidoksida (bistra kalcijeva lužina).
Reference
uredi- ↑ Hettne KM, Williams AJ, van Mulligen EM, Kleinjans J, Tkachenko V, Kors JA. (2010). „Automatic vs. manual curation of a multi-source chemical dictionary: the impact on text mining”. J Cheminform 2 (1): 3. DOI:10.1186/1758-2946-2-3. PMID 20331846.
- ↑ Joanne Wixon, Douglas Kell (2000). „Website Review: The Kyoto Encyclopedia of Genes and Genomes — KEGG”. Yeast 17 (1): 48–55. DOI:10.1002/(SICI)1097-0061(200004)17:1<48::AID-YEA2>3.0.CO;2-H.
- ↑ Gaulton A, Bellis LJ, Bento AP, Chambers J, Davies M, Hersey A, Light Y, McGlinchey S, Michalovich D, Al-Lazikani B, Overington JP. (2012). „ChEMBL: a large-scale bioactivity database for drug discovery”. Nucleic Acids Res 40 (Database issue): D1100-7. DOI:10.1093/nar/gkr777. PMID 21948594.
Literatura
uredi- Welch M. J., Lipton J. F., Seck J. A. (1969). „Tracer studies with radioactive oxygen-15. Exchange between carbon dioxide and water”. J. Phys. Chem. 73 (335): 3351. DOI:10.1021/j100844a033.
- Jolly, W. L. (1991). Modern Inorganic Chemistry (2nd Edn.). New York: McGraw-Hill. ISBN 0-07-112651-1.
- Moore M. H., Khanna R. (1991). „Infrared and Mass Spectral Studies of Proton Irradiated H2O+Co2 Ice: Evidence for Carbonic Acid Ice: Evidence for Carbonic Acid”. Spectrochimica Acta 47A: 255–262. DOI:10.1016/0584-8539(91)80097-3.
- W. Hage K. R. Liedl, Mayer E. Hallbrucker A. (1998). „Carbonic Acid in the Gas Phase and Its Astrophysical Relevance”. Science 279 (5355): 1332–1335. DOI:10.1126/science.279.5355.1332. PMID 9478889.
- Hage W., Hallbrucker A., Mayer E. (1993). „Carbonic Acid: Synthesis by Protonation of Bicarbonate and Ftir Spectroscopic Characterization Via a New Cryogenic Technique”. J. Am. Chem. Soc. 115: 8427–8431. DOI:10.1021/ja00071a061.
- Hage W., Hallbrucker A., Mayer E. (1995). „A Polymorph of Carbonic Acid and Its Possible Astrophysical Relevance”. J. Chem. Soc. Farad. Trans. 91: 2823–2826. DOI:10.1039/ft9959102823.