Ionische Flüssigkeit

Ionische Flüssigkeiten (englisch Ionic Liquids (IL), auch Room Temperature Ionic Liquids (RTIL)) sind Salze, deren Schmelztemperatur weniger als 100 °C beträgt. Wie alle Salze bestehen sie aus Anionen und Kationen. Durch deren Variation können die physikalisch-chemischen Eigenschaften einer ionischen Flüssigkeit in weiten Grenzen variiert und auf technische Anforderungen hin optimiert werden. Ionische Flüssigkeiten werden vor allem als Lösungsmittel verwendet und auf Grund ihrer strukturellen Vielfalt auch als designer solvents bezeichnet. So können sie zum Lösen von Cellulose und in elektrochemischen Prozessen eingesetzt werden. Auf Grund ihres geringen Dampfdrucks werden sie auch als grüne Lösungsmittel bezeichnet, dem entgegen steht jedoch ihr Bioakkumulationspotential sowie ihre Toxizität. Aktuelle Forschung beschäftigt sich mit der Synthese von biokompatiblen ionischen Flüssigkeiten.
Ionische Flüssigkeiten besitzen einen für Salze untypischen niedrigen Schmelzpunkt. Dieser kann durch den sterischen Anspruch, also die räumlich Ausdehnung der Ionen und durch Ladungsdelokalisierung in Anion und Kation erklärt werden. Bereits geringe thermische Energie genügt daher, um die Gitterenergie zu überwinden und die feste Kristallstruktur aufzubrechen.
Typische Kationen sind Imidazolium oder Pyridinium, Ammonium und Phosphonium. Als Anionen kommen Halogenide und schwach koordinierende Ionen, wie Tetrafluoroborate oder Hexafluorophosphate, aber auch Trifluoracetate, Triflate und Tosylate in Frage.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Die neuere Geschichte der ionischen Flüssigkeiten lässt sich in drei Generationen gliedern,[2][3] wobei die Grenzen fließend sind. Lediglich für die erste und zweite Generation lassen sich Publikationen finden, die den Beginn der Generation klar abstecken. Die Generationszählung beginnt allerdings erst in den 1980ern, als ionische Flüssigkeiten gezielt auf Grund ihrer Eigenschaften hergestellt und untersucht wurden. Die ersten Beschreibungen von Salzen, die die Definition der ionischen Flüssigkeiten erfüllen, wurden bereits 1876 publiziert.[4]
Erste Beschreibungen (1876–1929)
[Bearbeiten | Quelltext bearbeiten]
William Ramsay beschrieb 1876 Picolin und seine Derivate, darunter Picoliniumtribromid und Picoliniumtriiodid. Die Herstellung erfolgt durch Mischen der Halogene mit den entsprechenden Picolin-Hydrohalogeniden, wodurch sich die Trihalogenidionen Br3− und I3− bilden. Für das Picoliniumtribromid wird ein Schmelzpunkt von etwa 85 °C, für das Picoliniumtriiodid von 79 °C angegeben.[4] Durch Alkylierung von Picolin konnten 1899 weitere ionische Flüssigkeiten erhalten werden.[5] Für 1-Propyl-2-picoliniumiodid konnte beispielsweise ein Schmelzpunkt von 77 °C berichtet werden.[5] Auch das homologe 1-Butyl-2-picoliniumiodid ist mit einem Schmelzpunkt von 98 °C eine ionische Flüssigkeit.[5] Eine analoge Verbindung mit einem Isobutylrest zeigt einen Schmelzpunkt von unter −15 °C[5] und stellt damit die erste ionische Flüssigkeit dar, die bei Raumtemperatur flüssig ist.[6]
Eine weitere Substanz, deren exakte Struktur und damit auch die Einordnung als ionische Flüssigkeit über 100 Jahre unbekannt blieb, ist das sogenannte red oil (dt. rotes Öl).[7][8] Dieses fällt bei Friedel-Crafts-Alkylierungen als Nebenprodukt an, welche 1877 zum ersten Mal beschrieben wurden.[9] Strukturell handelt es sich beim red oil um ein flüssiges Salz mit dem Wheland-Intermediat als Kation und einem Dialuminiumheptachlorid-Komplex als Anion.[7]
1888 folgten Synthese und Beschreibung von Ethanolammoniumnitrat mit einem Schmelzpunkt von 52 °C durch Gabriel und Weiner.[10]
Trotz vorheriger Beschreibungen wird in der Literatur häufig Ethylammoniumnitrat (EAN) als erste ionische Flüssigkeit beschrieben.[11] 1914 synthetisierte Paul Walden EAN,[12] das einen Schmelzpunkt von 12 °C aufweist, durch Reaktion von Ethylamin und Salpetersäure. Zwar konnte Walden die Leitfähigkeit des EANs messen, allerdings blieb das Potential der ionischen Flüssigkeiten unentdeckt. Lediglich eine Studie über den Parachor (ein Maß für das Molvolumen bei gleicher Oberflächenspannung) einiger Salze von 1929 untersuchte die Eigenheiten von ionischen Flüssigkeiten.[13]
Weitere Entwicklungen (1950–1972)
[Bearbeiten | Quelltext bearbeiten]1951 konnte die erste Anwendung einer ionischen Flüssigkeit beschrieben werden. Hurley und Wier mischten 1-Ethylpyridiniumbromid mit Aluminiumchlorid und erhielten so ionische Flüssigkeiten mit verschiedenen Zusammensetzungen. Beim Variieren der Mischungsverhältnisse von Aluminiumchlorid zum Ethylpyridiniumbromid fanden sie zwei Eutektika: eines beim Verhältnis von 1:2 mit einem Schmelzpunkt von 45 °C und ein weiteres beim Verhältnis 2:1 mit einem Schmelzpunkt von −40 °C. Die 1:1-Mischung schmilzt bei 88 °C und ist damit ebenfalls eine ionische Flüssigkeit. Diese ionischen Flüssigkeiten konnten zur elektrochemischen Abscheidung von Aluminium auf verschiedenen Metallen verwendet werden.[14]
1963 beschrieb Yoke die Reaktion von Triethylammoniumhydrochlorid mit Kupfer(I)-chlorid, welche in einem flüssigen Produkt resultierte.[15] Da die Verbindung allerdings nicht luftstabil ist, da das Cu(I) oxidiert wird, wurde sie nicht weiter untersucht.
Eine erste ionische Flüssigkeit mit einem Tetrafluoroborat-Anion konnte 1966 von Kornblum und Coffey beschrieben werden.[16] Durch Umsetzung des Natriumsalzes des 2-Pyridon mit Triethyloxoniumtetrafluorborat kann N-Ethyl-2-ethoxypyridiniumtetrafluoroborat gewonnen werden, das bei 47,5–48,5 °C schmilzt.
Die Anwendung von ionischen Flüssigkeiten als Lösungsmittel konnte erstmals 1972 gezeigt werden. Parshall gelang es, zwei ionische Flüssigkeiten auf Tetraethylammonium-Basis herzustellen. Als Anionen dienten Trichlorstannat und Trichlorgermanat. Insbesondere das Tetraethylammoniumstannat kann als Lösungsmittel verwendet werden, da es bis zu 7 Gewichtsprozent Platin(II)-chlorid lösen kann. Diese Lösung kann als katalytisch wirksames Reaktionsmedium für Olefine dienen, welche hydriert, hydroformyliert oder carboalkoxyliert werden können.[17]
Erste Generation ionischer Flüssigkeiten (ab 1978)
[Bearbeiten | Quelltext bearbeiten]Als erste Generation ionischer Flüssigkeiten werden Haloaluminate bezeichnet.[2] Diese wurden zwar bereits 1951 von Hurley und Wier beschrieben,[14] aber erst in den 1970ern rückten sie in den Fokus der Forschung. Die US Air Force Academy forschte bereits seit Anfang der 1960er an niedrig schmelzenden Elektrolyten für die Anwendung in Batterien unter anderem in Kooperation mit Robert Osteryoung.[8] Die Publikationen beider Forschungsgruppen markieren den Start der modernen Ära der ionischen Flüssigkeiten: 1978 konnte Osteryoung erstmals das System Aluminiumchlorid:1-Butylpyridiniumchlorid (AlCl3-BPC) beschreiben und untersuchen.[18] Im gleichen Jahr meldete die US Air Force das Patent AlCl3 /1-alkyl pyridinium chloride room temperature electrolytes an.[19] Zwar schmelzen diese Salze früher als die bis dahin von der Air Force als Elektrolyte genutzten Mischungen aus Aluminiumchlorid und Natriumchlorid, allerdings ist die Mischung Aluminiumchlorid:1-Butylpyridiniumchlorid (1:1) nicht bei Raumtemperatur flüssig, sondern schmilzt erst bei 40 °C. Ein weiterer Nachteil ist das verschmälerte elektrochemische Fenster des Pyridinium-Kations, das reduziert werden kann.[8] Die Gruppe um Wilkes und Hussey begann darauf hin mit der Suche nach einem geeigneteren Kation, das gegenüber dem Aluminium reduktionsstabil ist. Durch semi-empirische Molekülorbital-Rechnungen konnten sie 1982 Dialkylimidazolium-Kationen als geeignete Kandidaten ausmachen und synthetisieren.[20]
Sowohl AlCl3-BPC als auch eine 1-Ethyl-3-methylimidazolium-Variante können als nicht wässrige und polare Lösungsmittel für Übergangsmetallkomplexe genutzt werden. So konnten z. B. Hexachloromolybdat(III)- und Hexachloromolybdat(IV)-Anionen erstmals in den ionischen Flüssigkeiten hergestellt und untersucht werden.[21] In den folgenden Jahren wurden ionische Flüssigkeiten immer öfter als katalytisch aktive Lösungsmittel untersucht. Anwendungen sind nukleophile aromatische Substitutionen in Tetraalkylphosphonium-ILs[22] oder Friedel-Crafts-Alkylierungen und -Acetylierungen in 1-Ethyl-3-methylimidazoliumtetrachloroaluminat.[23]
Zweite Generation ionischer Flüssigkeiten (ab 1992)
[Bearbeiten | Quelltext bearbeiten]Ein großer Nachteil der Chloroaluminat-basierten ionischen Flüssigkeiten ist ihre Anfälligkeit gegenüber Wasser. Bei der Hydrolyse entsteht unter anderem korrosive Salzsäure. Für die ursprüngliche Anwendung in der Batterietechnik war die Hydrolyseempfindlichkeit zwar unerheblich, da die Batterien ohnehin unter Feuchtigkeitsausschluss arbeiten mussten, jedoch war die Handhabung im Labor fast ausschließlich in der Glove-Box möglich. 1990 begann Mike Zaworotko bei der Air Force Academy[8] und publizierte 1992, gemeinsam mit Wilkes, das erste Paper über Luft- und Wasser-stabile ionische Flüssigkeiten.[24] Diese erhöhte Stabilität konnte durch Austausch des Chloroaluminat-Anions erreicht werden. Typische Anionen in ionischen Flüssigkeiten der zweiten Generation sind die Halide Chlorid, Bromid und Iodid, sowie Tetrafluoroborat, Hexafluorophosphat oder Benzoat.[3] 1996 wurden erstmals perfluorierte Anionen, wie Bis(trifluormethylsulfonyl)amid, Triflat oder Trifluoroacetat in Imidazolium-basierten ionischen Flüssigkeiten genutzt. Diese ionischen Flüssigkeiten zeichnen sich durch ihre Hydrophobie, einen niedrigen Schmelzpunkt, teils unter −30 °C und eine hohe Leitfähigkeit aus.[25]
Dritte Generation ionischer Flüssigkeiten (um 2000 bis heute)
[Bearbeiten | Quelltext bearbeiten]Nachdem die neuen Anionen der zweiten Generation das Feld der ionischen Flüssigkeiten vergrößerten, sollte die dritte Generation das Spektrum auf geschätzte 1018 mögliche Kombinationen[7] erweitern. Sogenannte "task-specific ionic liquids" oder "designer solvents" wurden aus diesem Pool generiert und gezielt für spezifische Anwendungen maßgeschneidert. Dazu gehören chirale ionische Flüssigkeiten[2] und "deep eutectic solvents".[3] Häufig werden die ionischen Flüssigkeiten der dritten Generation im Zusammenhang mit "grüner" Chemie genannt, da sie eine Alternative zu den volatilen, toxischen und flammbaren gängigen Lösungsmitteln sind.[7]
Bereits 1996 wurde der erste großtechnische Prozess von Eastman Chemical gefahren, der eine ionische Flüssigkeit nutzt.[26]
Herstellung
[Bearbeiten | Quelltext bearbeiten]
Die Synthese ionischer Flüssigkeiten erfolgt meist in zwei Schritten: Im ersten Schritt wird das gewünscht Kation hergestellt, meist durch eine Quaternisierungsreaktion, im zweiten Schritt folgt eine Anionenmetathese.[27][28]
Quaternisierung
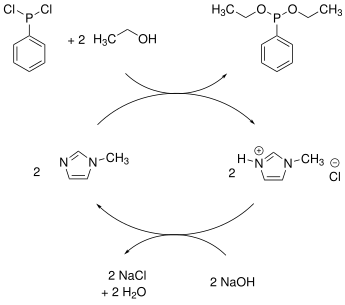
[Bearbeiten | Quelltext bearbeiten]Bei der Quaternisierungsreaktion handelt es sich um eine nucleophile Substitution. Ein Alkylierungsmittel, meist ein Halogenalkan, wird mit einem stickstoffhaltigen Heteroaromaten, wie Pyridin- oder Imidazol-Derivaten, umgesetzt. Die Methode lässt sich auch für andere, ausreichend nucleophile Substanzen anwenden, wie zum Beispiel Amine. Handelt es sich bei der Abgangsgruppe im Alkylierungsmittel bereits um das gewünschte Anion, so ist die Synthese der ionischen Flüssigkeiten bereits abgeschlossen.[27] Besondere Relevanz hat dies bei der Halogenid-freien Synthese von ionischen Flüssigkeiten. Als Alkylierungsmittel könnten Dimethyl- und Diethylsulfat dienen.[26] Weitere Beispiele, bei denen die ionischen Flüssigkeiten durch die Quaternisierungsreaktion erhalten werden, sind Alkylierungen mit Methyltriflat oder die Synthese von [BMIM]Cl aus Methylimidazol und Chlorbutan.[27]

- Synthese von [BMIM]Cl (TSM = 70 °C[29]) als Beispiel für eine Quaternisierungsreaktion
Zincke-Reaktion
[Bearbeiten | Quelltext bearbeiten]Pyridinium- und Imidazolium-Salze können in einer Ultraschall-unterstützten Zincke-Reaktion hergestellt werden.[30] Die Anwendung ist jedoch begrenzt und nicht auf chirale Amine anwendbar.[31]
Anionenmetathese
[Bearbeiten | Quelltext bearbeiten]Um das gewünschte Anion zu erhalten, gibt es prinzipiell drei Möglichkeiten, um das Anion auszutauschen:
Bei der Umsetzung mit einem Metall- oder Ammoniumsalz M+[A]− wird das Löslichkeitsverhalten von ionischen Flüssigkeiten und dem entstehenden, ungewünschten Salz ausgenutzt. Entweder fällt dieses direkt aus dem Lösungsmittel aus, wie es für viele Silbersalze der Fall ist, oder es werden Zwei-Phasen-Gemische genutzt.[28]

- Anionenmetathese von [BMIM]Cl mit AgBF4 in Methanol zu [EMIM][BF4] (TSM = 15 °C)[24]
Statt dem Metallsalz kann die Brønsted-Säure des Anions eingesetzt werden. Ein Vorteil dieser Methode ist, dass durch Abdampfen der Säure des ungewünschten Anions die Aufreinigung einfach ist.[28]

- Anionenmetathese von [EMIM]Cl mit HPF6 in Wasser zu [EMIM][PF6] (TSM = 58–60 °C)[32]
Die dritte Möglichkeit ist der Einsatz eines Austauscherharzes.[28] Im Labormaßstab wird eine Säule mit einem Austauscherharz wie Amberlist 26, das quartäre Ammoniumgruppen auf der Oberfläche trägt, eingesetzt. Das kommerziell erhältliche Harz liegt in der OH-Form vor, die Anionen sind Hydroxidionen. Diese können ausgetauscht werden, indem eine Lösung mit dem gewünschten Anion in Form der konjugierten Säure, einem Metall- oder Ammoniumsalz über die Säule gegeben wird. Die Hydroxidionen werden von der Säule gewaschen, die gewünschten Anionen verbleiben auf der Säule. Über die vorbehandelte Säule kann eine Lösung des gewünschten Kations, meist als Halidsalz, gegeben werden. Während der Elution werden die Anionen ausgetauscht und die gewünschte Ionenkombination wird erhalten. Als Beispiel dient die Herstellung von 1-Butyl-3-methylimidazoliumacetat:[33]
Lewis-Säuren
[Bearbeiten | Quelltext bearbeiten]Ein anderer Ansatz ist das Umsetzen des Anions mit einer Lewis-Säure. Beispielsweise kann ein Chlorid-Salz mit Aluminiumtrichlorid gemischt werden. Auf diesem Weg entsteht das Tetrachloroaluminatanion.
Diese Methode wird zur Synthese der ionischen Flüssigkeiten der ersten Generation genutzt.[28]
Protische ionische Flüssigkeiten
[Bearbeiten | Quelltext bearbeiten]Protische ionische Flüssigkeiten lassen sich durch eine Säure-Base-Reaktion herstellen. Dabei handelt es sich um eine Gleichgewichtsreaktion, die von der Säure- und Basen-Stärke abhängig ist.[34]
- Säure + Base steht im Gleichgewicht zur konjugierten (korrespondierenden) Base + konjugierten (korrespondierenden) Säure
Durch die Gleichgewichtsreaktion besitzen viele protische ionische Flüssigkeiten einen relevanten Dampfdruck und lassen sich durch Destillation aufreinigen.[34] Ein Beispiel für eine auf einem tertiären Amin basierende protisch ionische Flüssigkeit ist das Ethylammoniumnitrat.

- Synthese von EAN (TSM = 12 °C) aus Ethylamin und Salpetersäure[12]
Aufreinigung
[Bearbeiten | Quelltext bearbeiten]Die Reinheit der ionischen Flüssigkeiten spielt eine entscheidende Rolle für ihre Anwendung, weshalb einige Methoden zur Aufreinigung diskutiert werden. Für ionische Flüssigkeiten mit vernachlässigbarem Dampfdruck bietet sich die Destillation an, um flüchtige Verunreinigungen zu entfernen. Diese Methode ist einfach durchzuführen, ist aber auf Grund des Energiebedarfs kostenintensiv. Lässt sich die ionische Flüssigkeit auskristallisieren, so kann eine energieintensive Umkristallisation zu sehr reinen Produkten führen. Eine weniger energieintensive Methode ist der Einsatz von Membranen. So kann z. B. durch Pervaporation die selektive Trennung zweier Flüssigkeiten erfolgen. Problematisch ist das Membranfouling. Je nach Verunreinigung kann eine Extraktion zum gewünschten Ergebnis führen. Extraktionen sind zwar einfach und ökonomisch durchzuführen, benötigen jedoch spezielle Apparaturen und können zu Kreuzkontaminationen durch Extraktionsmittel wie Wasser, überkritisches Kohlenstoffdioxid oder organische Lösungsmittel führen. Limitierte Anwendung finden Zentrifugen oder das Ausnutzen von Magnetismus. Beide Methoden sind zwar einfach durchzuführen, liefern allerdings selten hohe Reinheit. Ein weiterer Ansatz zur Aufreinigung von ionischen Flüssigkeiten stellen wässrige biphasische Systeme dar. Zwar benötigen diese Systeme große Mengen an Salzen oder organischen Substanzen, um zu funktionieren, sind aber ökonomisch und können für Scale-up eingesetzt werden.[35]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]| Eigenschaft | organisches Lösungsmittel | ionische Flüssigkeit |
|---|---|---|
| Anzahl | >1000 | >106 |
| prozessspezifische Funktion | einzelfunktional | multifunktional |
| Kosten | gering | 2–100 mal höher als org. Lösungsmittel |
| Dampfdruck | besitzen einen Dampfdruck (VOCs) | kein nennenswerter Dampfdruck |
| Entflammbarkeit | meist entflammbar | nicht entflammbar |
| Anpassungsfähigkeit | begrenzte Anzahl | designer solvents |
| Chiralität | selten | üblich und anpassbar |
| Katalytische Aktivität | selten | üblich und anpassbar |
| Viskosität [mPa·s] | 0,2–100 | 20–97000 |
| Dichte [g·cm−3] | 0,6–1,7 | 0,8–3,3 |
| elektrische Leitfähigkeit [mS·cm−1] | meist Isolatoren | bis 120 |
| thermische Leitfähigkeit [W·m−1·K−1] | 0,1–0,6 | 0,1–0,3 |
Ionische Flüssigkeiten zeichnen sich durch eine Reihe interessanter Eigenschaften aus. Durch die große Anzahl an Möglichkeiten lassen sich die Eigenschaften nur teilweise zusammenfassen und einige ionische Flüssigkeiten unterscheiden sich erheblich voneinander. Die meisten ionischen Flüssigkeiten sind thermisch vergleichsweise stabil, schwer entzündlich, haben einen sehr niedrigen, kaum messbaren Dampfdruck und verfügen für zahlreiche Substanzen über sehr gute Lösungseigenschaften. Sie besitzen aufgrund ihres rein ionischen Aufbaus interessante elektrochemische Eigenschaften, wie z. B. elektrische Leitfähigkeit, die oft von einer hohen elektrochemischen Stabilität gegen Oxidationen und Reduktionen begleitet wird. Ein Vergleich mit konventionellen, organischen Lösungsmitteln zeigt einige der besonderen Eigenschaften der ionischen Flüssigkeiten und entscheidende Unterschiede. Eine der Eigenschaften, die für die Anwendung von ionischen Flüssigkeiten als Lösungsmittel entscheidend ist, ist der niedrige, meist vernachlässigbare Dampfdruck. Während VOCs ein umwelt- und arbeitsschutzrelevantes Problem darstellen, sind ionische Flüssigkeiten in dieser Hinsicht unbedenklich und können sogar für Anwendungen im Weltraum genutzt werden.[36][37] Eine Ausnahme stellen hier die protischen ionischen Flüssigkeiten (PIL) dar, die durch das Säure-Base-Gleichgewicht einen höheren Dampfdruck besitzen. Eine ebenfalls sicherheitsrelevante Eigenschaft ist die Entflammbarkeit. Ionische Flüssigkeiten sind in der Regel nicht entflammbar, wobei diese Eigenschaft gezielt verändert werden kann, z. B. für Treibstoffe.[36][38] Die herausragende Eigenschaft, die ionische Flüssigkeiten erst in den Fokus der Forschung gebracht hat, ist die elektrische Leitfähigkeit. Erst durch diese Eigenschaft sind ionische Flüssigkeiten für elektrochemische Anwendungen geeignet, wie Energiespeicherung und -umwandlung.[39] Sie können zum Beispiel in der Batterietechnik und Solarzellen[40] eingesetzt werden. Durch Variation der Seitenketten des Kations und die Auswahl geeigneter Anionen lässt sich zum Beispiel die Löslichkeit in Wasser oder organischen Lösungsmitteln weitgehend frei bestimmen. Ähnliches gilt für den Schmelzpunkt und die Viskosität. Durch entsprechende funktionelle Gruppen können sie als Säuren, Basen oder Liganden synthetisiert werden. So können sie in Anwendungen nicht nur die Rolle als Lösungsmittel einnehmen, sondern darüber hinaus als Katalysator wirken oder eine Stereoinformation in eine Reaktion einbringen.
Zumindest einige ionische Flüssigkeiten (1-Butyl-3-methylimidazoliumbis(trifluoromethyl-sulfonyl)imid und 1-Hexyl-3-methylimidazoliumbis(trifluoromethylsulfonyl)imid) zeigen unter Druck den piezoelektrischen Effekt, der zuvor nur bei Festkörpern bekannt war.[41]
Schmelzpunkt
[Bearbeiten | Quelltext bearbeiten]Die definierende Eigenschaft von ionischen Flüssigkeiten ist der Schmelzpunkt. Die exakte Bestimmung des Schmelzpunktes ist häufig nicht trivial, da es beim Abkühlen von ionischen Flüssigkeiten zu einem Glasübergang kommen kann.
Der Schmelzpunkt wird im Wesentlichen durch die elektrostatische Wechselwirkung zwischen Anion und Kation bestimmt. Diese Wechselwirkung lässt sich durch folgende Gleichung für die Gitterenergie beschreiben:[42]
Aus der Gleichung geht hervor, dass drei Faktoren die Größe der Wechselwirkung beeinflussen:
- Die Ladung der Ionen und : Für eine kleine Wechselwirkung und somit einen niedrigen Schmelzpunkt sollten sowohl Anion als auch Kation nur einfach geladen sein.
- Den Abstand zwischen den Ionen : Größere Ionen führen zu höheren Abständen und somit zu niedrigeren Schmelzpunkten.
- Die Packungseffizienz der Ionen, angegeben durch die Madelung-Konstante : Diese wird durch das Maß an Asymmetrie in den Ionen beeinflusst. Eine höhere Asymmetrie führt meist zu niedrigeren Schmelzpunkten.
Weitere Faktoren sind van-der-Waals-Wechselwirkungen, π-π-Wechselwirkungen und Wasserstoffbrückenbindungen.[42][43]
Daraus leiten sich Trends ab, die neben den Einflüssen der Ionenladungen helfen, den Schmelzpunkt einer ionischen Flüssigkeit vorauszusagen:[42][43]
- Hohe konformative Flexibilität und chirale Zentren führen zu einem niedrigeren Schmelzpunkt.
- Weniger effiziente Packung führt zu niedrigerem Schmelzpunkt.
- Hohe Symmetrie führt zu einem höheren Schmelzpunkt.
- Zahl und Ausmaß der Wasserstoffbrückenbindungen, wobei Anionen mit hoher Tendenz zu H-Brücken (CH3COO−) als auch Anionen, die keine H-Brücken ausbilden können ([(CF3SO2)N]−), niedrige Schmelzpunkte aufweisen
- Funktionelle Gruppen wie z. B. Etherfunktionen führen zu niedrigeren Schmelzpunkten.
Kristallstruktur
[Bearbeiten | Quelltext bearbeiten]
Für [BMIM]Cl und [BMIM]Br sind die Kristallstrukturen bekannt. Im Fall des Chloridsalz sind zwei Kristallstrukturen bekannt, eine orthorhombische und eine monokline. Die Struktur von [BMIM]Br ist orthorhombisch. Die monokline Struktur weist in der Butylseitenkette eine trans-trans-Konformation im Bezug auf die C7-C8- und C8-C9-Bindung auf, während die orthorhombischen Strukturen eine gauche-trans-Konformation zeigen.[44][45] Beiden Konformationen können Peaks im Raman-Spektrum zugeordnet werden, was Rückschlüsse auf die Konformation von flüssigen [BMIM]-Salzen zulässt.[45][46]
Flüssigphase
[Bearbeiten | Quelltext bearbeiten]Da es sich bei der Substanzklasse um ionische Strukturen handelt, muss in der Flüssigphase eine gewisse Nahordnung vorliegen, um die lokale Ladungsneutralität zu gewährleisten. Diese Strukturen wurden sowohl theoretisch, als auch praktisch untersucht. In Molekulardynamik-Simulationen von Salzen mit einem 1-Alkyl-3-Methylimidazoliumkation [CnMIM]+ konnte gezeigt werden, dass sich die Nanostrukturen innerhalb der Flüssigphase je nach Länge des Alkylrestes, aber auch in Abhängigkeit des Anions ändern. Bei der Untersuchung einer Reihe von Hexafluorphosphaten [CnMIM][PF6] konnte für kleine Alkylreste (C2–C4) inselartige Strukturen gefunden werden. Dabei richten sich die Alkylreste zueinander aus und bilden so kohlenwasserstoffartige Bereiche innerhalb des ansonsten kontinuierlichen polaren Netzwerks aus. Für größere Anionen, wie das Bistriflimid [NTf2]− ändert sich die obere Alkyllänge, bei der Inseln entstehen, hin zu C6. Steigt die Kettenlänge über dieses Limit, bilden die unpolaren Bereiche eine zweite Mikrophase aus, sodass sich eine bikontinuierlich getrennte Phase ergibt. Die Phasenbildung ist dabei unabhängig von der Herkunft der unpolaren Alkylkette. So ordnen sich auch Anionen, wie Alkylsulfonate [CmSO3]− in bikontinuierlichen Phasen an. Für sehr lange Alkylketten (m+n>12) bilden sich schichtartige Strukturen, die als Übergang zu flüssigkristallinen Phasen verstanden werden können.[47] Solche smektischen Phasen werden zum Beispiel von [C8MIM][C8SO3] ausgebildet.[48] Die Art des Kations hat einen Einfluss auf die Morphologie des polaren Netzwerks. Imidazoliumkationen können zusätzlich zu Ionenbindungen über Wasserstoffbrücken, ausgehend von den Wasserstoffen am C2-Atom und im geringen Maße denen am C4- und C5-Atom, mit Anionen interagieren. So können mehr als zwei Wechselwirkung zu Anionen ausgebildet werden, was zu einem verzweigten polaren Netzwerk führt. Im Gegensatz dazu stehen die quartären Ammonium- und Phosphoniumkationen, deren ladungstragende Atome von Alkylketten abgeschirmt sind. Durch die limitierten Ioneninteraktionen bilden sich fadenartige polare Strukturen aus.[47]

Für 1-Alkyl-1-methylpyrrolidiniumbis(trifluormethylsulfonyl)amide [CnC1Pyrr][NTf2] kann ein ähnlicher Trend beobachtet werden. Bis zu einer Kettenlänge von n=8 organisiert sich diese ionische Flüssigkeit in alternierende Monolagen aus Anionen und Kationen. Ab einer Kettenlänge von n=10 bildet sich eine Doppelschicht, ähnlich einer Doppellipidschicht, aus.[49] Die Wechselwirkungen in den alternierenden Monolagen können durch Poisson-Boltzmann-Gleichungen höherer Ordnung beschrieben werden.[50]
Durch Raman-Spektroskopie kann die Konformation der Seitenketten in Imidazolium-basierten ionischen Flüssigkeiten untersucht werden. Dank kristallographischer Voruntersuchungen können Banden im Raman-Spektrum einer trans-trans-Konformation und einer gauche-trans-Konformation zugeordnet werden. Beide Konformationen liegen in [BMIM]X (X− = Cl−, Br−, I−, PF6−, BF4−) vor, was auf zwei verschieden lokale Strukturen schließen lässt. Diese koexistieren und sind spezifisch für die jeweilige Konformation. Diese Koexistenz kann als ein Grund angenommen werden, warum diese ionischen Flüssigkeiten schlecht auskristallisieren und häufig unterkühlte Schmelzen bilden.[45][51]
Elektrochemisches Fenster
[Bearbeiten | Quelltext bearbeiten]Das elektrochemische Fenster (electrochemical window, EW) gibt die Größe des Bereichs an, in dem eine Substanz weder oxidiert noch reduziert wird. Es beschreibt also die Differenz zwischen den limitierenden Potentialen an Anode und Kathode:[52]

Umso größer das elektrochemische Fenster ist, umso stabiler ist eine Substanz gegenüber Oxidation und Reduktion. Ionische Flüssigkeiten zeichnen sich durch ein sehr großes elektrochemisches Fenster aus. Dabei ist meist das Kation für das limitierende Reduktionspotential an der Kathode und das Anion für das Oxidationspotential an der Anode verantwortlich. Eine Ausnahme stellt das Heptachloroaluminat-Anion Al2Cl7− dar.[53] Typische elektrochemische Fenster liegen im Bereich von 3 bis 6 V.[53] Im Vergleich mit Wasser, das ein relativ kleines Fenster von 1,2 V besitzt, zeigt sich hier der Vorteil von ionischen Flüssigkeiten in elektrochemischen Anwendungen. Beispielsweise besitzt [BMIM][BF4] ein elektrochemisches Fenster von 4,1 V, [BMIM][PF6] eines von 4,15 V, während [BMPyrr][NTf2] ein Fenster von 5,5 V besitzt.[26] Ein herausragendes Beispiel ist das 1-Methyl-1-propylpiperidiniumhexafluorophosphat mit einem elektrochemischen Fenster von 7,2 V, das durch ein Kathodenpotential von −3,25 V und ein Anodenpotential von 3,95 V limitiert wird. Durch seinen Schmelzpunkt von 100 °C fällt es allerdings fast aus der Definition einer ionischen Flüssigkeit heraus.[52] Damit das große elektrochemische Fenster von ionischen Flüssigkeiten voll ausgeschöpft werden kann, ist es wichtig, diese sowohl Wasser- als auch Halogenid-frei zu synthetisieren. 3 wt% Wasser führen bereits dazu, dass das elektrochemische Fenster von [BMIM][BF4] von 4,1 auf 1,95 V sinkt.[53]
Strukturklassen
[Bearbeiten | Quelltext bearbeiten]Ionische Flüssigkeiten lassen sich auf Grund struktureller Merkmale in verschiedene Klassen einteilen.[35] Es ist möglich, dass ionische Flüssigkeiten in mehreren Klassen stehen, z. B. werden chirale ionische Flüssigkeiten häufig aus Stoffen aus dem chiral pool synthetisiert, wodurch sie ebenfalls die Definition einer bio-ionischen Flüssigkeit erfüllen.
| Name | Eigenschaften | Anwendungensbeispiel | Beispielstruktur |
|---|---|---|---|
| Anwendungsspezifische ionische Flüssigkeit (task specific ionic liquid, TS-IL) |
für spezielle Anwendung optimiert, funktionelle Gruppe | CO2-Fixierung[54] | 
|
| chirale ionische Flüssigkeit (C-IL) |
chiral | chirale Solvatationsreagenzien[55] | 
|
| Ionische Flüssigkeit mit schaltbarer Polarität (switchable polarity solvent ionic liquid. SPS-IL) |
Polaritätsänderung durch molekularen Trigger, wie CO2 | Trennprozesse[56] | 
|
| Bio-ionische Flüssigkeit (B-IL) |
aus nachwachsenden Rohstoffen synthetisiert | Katalyse[57] | 
|
| Poly-ionische Flüssigkeit (P-IL) |
Polymere, deren Monomer eine ionische Flüssigkeit ist, oder ein Komposit aus ionischer Flüssigkeit und Polymer |
Energiespeicher[58] | 
|
| Energetische ionische Flüssigkeiten (E-IL) |
hohe Menge chemischer Energie | Treibstoff[59] | 
|
| neutrale ionische Flüssigkeit (N-IL) |
Anion mit geringer elektrostatischer Wechselwirkung | inertes Reaktionsmedium[60] | |
| protische ionische Flüssigkeit (P-IL) |
Salzbildung durch Säure-Base-Reaktionen nach Brønsted | Katalyse[61] | |
| Brønsted-azide ionische Flüssigkeit (BA-IL) |
sauer | Katalyse[62] | 
|
| basische ionische Flüssigkeit (B-IL) |
basisch | Lithium-Elektrochemie[63] | 
|
| metallische ionische Flüssigkeit (M-IL) |
Metall-basierte Ionen | Entschwefelung[64] | 
|
| geträgerte ionische Flüssigkeit (supported ionic liquid, S-IL) |
Ionen an eine Trägersubstanz gebunden | Katalyse[65] | 
|
Verwendung
[Bearbeiten | Quelltext bearbeiten]Die molekulare Vielfalt ionischer Flüssigkeiten ermöglicht prinzipiell ihren Einsatz in einer Vielzahl technischer Anwendungsgebiete. Ihr Einsatz in großtechnischen Prozessen zeigt die Relevanz in der chemischen Verfahrens- sowie Reaktionstechnik. Anwendungen in der Bioverfahrenstechnik[66][67] sind bekannt. Eines der Hauptanwendungsgebiete der ionischen Flüssigkeiten ist der Einsatz als Elektrolyt in Brennstoffzellen, Kondensatoren, Batterien, Farbstoffsolarzellen und der Metallveredelung. Darüber hinaus dienen ionische Flüssigkeiten als Modellsysteme für Elektroden-Elektrolyt-Grenzflächen.[68] Weitere Anwendungen sind der Wärmetransport, der Einsatz als Kühlmittel[69] und als ionischer Verdichter, sowie in der Spezialanalytik als Matrix-Materialien für GC-Headspace und MALDI-TOF-MS, Lösungsmittel für das Karl-Fischer-Verfahren, Medien für die Proteinkristallisation und die Elektrophorese. In der Synthese können ionische Flüssigkeiten sowohl als Katalysator als auch als Lösungsmittel fungieren. Dabei werden sowohl organische und anorganische Synthesen, wie auch Polymer und Nanopartikel abgedeckt.
Elektrolyt
[Bearbeiten | Quelltext bearbeiten]Farbstoffsolarzellen
[Bearbeiten | Quelltext bearbeiten]Mittels Farbstoffsolarzellen lässt sich gegenüber kristallinen Silizium-Solarzellen ein erweiterter Bereich des Lichtspektrums nutzen, was den Einsatz bei diffusem Licht oder geringerer Lichtintensität ermöglicht. Die ionischen Flüssigkeiten können als neuartiges Elektrolytmaterial verwendet werden. Der Nutzen liegt hier in ihrer Leitfähigkeit, die für den erforderlichen Ladungstransport sorgt. In Kombination mit den Eigenschaften eines niedrigen Schmelzpunktes und eines sehr geringen Dampfdrucks eröffnet sich ein Anwendungsbereich bei Temperaturen von −20 bis +80 °C. Zudem verfügen sie über eine hohe elektrochemische Stabilität. Eine Anwendung zielt auf eine Verwendung dieser Zellen z. B. als Ladegerät für mobile Telefone in Regionen ohne flächendeckende Stromversorgung.[70]
Batterien
[Bearbeiten | Quelltext bearbeiten]In vielen kommerziellen Lithium-Ionen-Akkumulatoren werden oft organische Lösungsmittel, z. B. Carbonate als Elektrolyt eingesetzt. Diese besitzen jedoch eine Reihe von Nachteilen. Organische Carbonat-Lösungsmittel besitzen gegenüber ionischen Flüssigkeiten eine limitierende Stabilität gegenüber Oxidation bei hohen positiven Potentialen (etwa 4,3–4,9 V vs. Li+/Li) je nach verwendeter Elektrode.[71] Dies führt zu einer zunehmenden Zersetzung des Elektrolyten mit fortschreitender Zyklisierung bei diesen Potentialen. Aufgrund der damit einhergehenden Effizienzeinbußen sind organische Lösungsmittel lediglich für ein kleines Potentialfenster geeignet. Ein weiterer Vorteil ist die thermische Stabilität und geringe Volatilität von ionischen Flüssigkeiten. Unerwünschte exotherme Reaktionen können zwischen dem Elektrolyten und anderen Batteriekomponenten durch eine lokale Überhitzung oder einen Kurzschluss auftreten. Die stark ansteigende Zelltemperatur kann zu einem Entzünden des organischen Lösungsmittels führen.[72] Ein gewichtiger Nachteil für den Einsatz von ionischen Flüssigkeiten als Elektrolyt ist die geringe ionische Leitfähigkeit, da sie eine geringe Ladungsdichte und eine große sterische Hinderung besitzen.[73]
Celluloseveredelung
[Bearbeiten | Quelltext bearbeiten]Cellulose ist mit einem Vorkommen von etwa 700 Milliarden Tonnen die mengenmäßig größte natürliche organische Substanz auf der Erde und als nachwachsender Rohstoff von großer Bedeutung. Von den durch die Natur jährlich nachgebildeten 40 Milliarden Tonnen werden nur etwa 0,2 Milliarden Tonnen als Rohstoff für eine weitere Veredelung verwertet. Einer erweiterten Nutzung der Cellulose als Rohstoff steht entgegen, dass es an einem geeigneten Lösemittel fehlt. Durch den Einsatz ionischer Flüssigkeiten können erstmals Lösungen von Cellulose in technisch nutzbaren Konzentrationen bereitgestellt werden.[74][75][76] So müssen bei der Herstellung von synthetischen Cellulosefasern (z. B. Viskose) aus sogenanntem Chemiezellstoff verschiedene Hilfschemikalien, speziell Kohlenstoffdisulfid (CS2), in großen Mengen eingesetzt und anschließend rezykliert oder entsorgt werden. Zusätzlich müssen verfahrensbedingt erhebliche Mengen von Abwasser aufgearbeitet werden. Diese Prozesse lassen sich durch den Einsatz ionischer Flüssigkeiten möglicherweise vereinfachen, da sie als Lösungsmittel verwendet und fast vollständig rezykliert werden könnten. Das Institut für Textilchemie und Chemiefasern (ITCF) und die BASF untersuchen gemeinsam die Eigenschaften von Fasern, die in einer Pilotanlage aus mit Hilfe von ionischen Flüssigkeiten gelöster Cellulose gesponnen werden.[77]
Die gute Löslichkeit von Cellulose in ionischen Flüssigkeiten eröffnet vielfältige Möglichkeiten zur Herstellung von Werkstoffen auf Basis nachwachsender Rohstoffe.[70] In einer einstufigen Synthese kann Cellulose in Gegenwart von gekoppelten Kupfer(II)-chlorid/Chrom(II)-chlorid-Katalysatoren im Lösungsmittel 1-Ethyl-3-methylimidazoliumchlorid bei 80–120 °C zu 5-Hydroxymethylfurfural (HMF) umgesetzt werden, welches als ein möglicher Baustein für Kunststoffe auf der Basis von Biomasse gilt.[78][79]
Pharmazeutika
[Bearbeiten | Quelltext bearbeiten]
Über 50 % der kommerziell verfügbaren Pharmazeutika liegen als Salze vor, meist ist aber nur eins der Ionen organischer Natur. Die populärsten Gegenionen sind Natrium und Chlorid.[81] Substanzen mit biologischer Aktivität verfügen meist über funktionelle Gruppen, die in Ionen überführt werden können. Beispielsweise können Amine Kationen bilden, Säurefunktionalitäten können Anionen bilden.
Auf dieser Grundlage können zwei Ansätze verfolgt werden. Im einen Ansatz wird versucht, durch Kombination zweier biologisch aktiver Ionen ein Produkt zu erhalten, das sowohl die Aktivität der anionischen als auch der kationischen Komponente aufweist. Optimal ist dabei eine synergistische Wirkung zwischen den Ionen, die eine Verstärkung des gewünschten Effekts hervorruft.[82][83] Ein anderer Ansatz „verflüssigt“ die biologisch aktive ionische Komponente durch Wahl eines inerten oder biokompatiblen Gegenions. Dadurch können unter Umständen Probleme umgangen werden, die durch die Polymorphie vieler Salze entstehen.[80][84]
Darüber hinaus können ionische Flüssigkeiten in der Synthese von Medikamenten, als Lösungsmittel, Emulgator oder drug delivery system eingesetzt werden.[82]
Trotz diverser vielversprechender Ansätze mit biologisch aktiven ionischen Flüssigkeiten sind bisher nur wenige über das Stadium des Proof of Concept hinausgekommen. Zugelassen sind Cetylpyridiniumchlorid als Antiseptikum und (in den USA) Bretyliumtosylat als Antiarrhythmikum, die allerdings nicht gezielt als ionische Flüssigkeiten hergestellt werden.[80] Eine Kombination von Lidocain und Etodolac zu einer ionischen Flüssigkeit führt zu einer erhöhten Hautdurchlässigkeit des Etodolac.[85] Die Firma IL Pharma untersuchte diese ionische Flüssigkeit in Form eines Pflasters unter dem Namen Etoreat, in einer Phase-III-Studie konnten jedoch keine statistisch relevanten Ergebnisse erzielt werden.[86]
Biotechnologie
[Bearbeiten | Quelltext bearbeiten]Ionische Flüssigkeiten erweitern das Repertoire an Biotransformationen, da in ihnen wasserempfindliche Reaktionen durchgeführt werden können.[87] Pionierarbeiten zu Biotransformationen in ionischen Flüssigkeiten lieferte die Gruppe um Roger A. Sheldon im Jahr 2000 über die Lipase-katalysierten Reaktion Alkoholyse, Ammonolyse und Perhydrolyse. Dabei wurde die Candidaantarctica Lipase B (CaLB) in den ionischen Flüssigkeiten [BMIM][PF6] und [BMIM][BF4] verwendet.[88] Seitdem konnten in vielen Prozessen eine hohe Selektivität und Aktivität von Enzymen in ionischen Flüssigkeiten gezeigt werden. Darüber hinaus können ionische Flüssigkeiten die Stabilität, die Enantioselektivität und die katalytische Aktivität beeinflussen.[87][67][66] Zu den in ionischen Flüssigkeiten aktiven Enzymklassen gehören unter anderen Proteasen, Lipasen, Esterasen, Glycosidasen und Oxidoreduktasen.[87] Für die Umsetzungen kann sowohl ein Ein- als auch ein Zwei-Phasen-System verwendet werden. So können neben den Enzymen auch ganze Zellen eingesetzt werden. Für den Einsatz in einem Zwei-Phasen-System mit Wasser kann das Enzym in der ionischen Flüssigkeit immobilisiert werden. Durch Variation der Löslichkeit der ionischen Flüssigkeit können Mischungen mit Wasser genutzt werden.[87]
Großtechnische Anwendungen
[Bearbeiten | Quelltext bearbeiten]2,5-Dihydrofuran
[Bearbeiten | Quelltext bearbeiten]Die erste großtechnische Anwendung, die eine ionische Flüssigkeit nutzte, war ein Isomerisierungs-Prozess der Eastman Chemical. Der Prozess lief zwischen 1996 und 2004 mit bis zu 1400 Jahrestonnen. Es wurde 2,5-Dihydrofuran aus 3,4-Epoxy-1-buten hergestellt, als Katalysator diente Trioctylzinniodid als Lewis-Säure und eine Lewis-basische Tetraalkylphosphonium-basierte ionische Flüssigkeit ([P88818][I]). Im kontinuierlich geführten Prozess konnte das Katalysatorgemisch von Produkt abgetrennt und recyclet werden. Als Nebenprodukte fallen Crotonaldehyd (1 %) sowie Oligomere (2 %) an.[89][26][36]
BASIL-Prozess
[Bearbeiten | Quelltext bearbeiten]BASF nutzt mit Methylimidazoliumchlorid eine ionische Flüssigkeit im BASIL-Prozess (biphasic acid scavenging using ionic liquids). In dem Prozess wird Dichlorphenylphosphan mit Ethanol zu Diethoxyphenylphosphin, einem Zwischenprodukt in der Synthese von Photoinitiatoren[90], umgesetzt. 1-Methylimidazol wird als Hilfsbase eingesetzt, um die entstehende Salzsäure zu neutralisieren. Dabei bildet sich die ionische Flüssigkeit, die sich als zweite Phase abscheidet und sich so leicht abtrennen lässt. Da die Aufreinigung des Produktes einfacher wurde, konnte die Produktivität des Prozesses um den Faktor 80000 gesteigert werden. Vormals wurde statt dem Methylimidazol ein tertiäres Amin zugesetzt, welches aber ein schlecht abtrennbares Salz mit der Salzsäure bildete. Im BASIL-Prozess wird Diethoxyphenylphosphan gewonnen.[26][91]
ISOALKY-Prozess
[Bearbeiten | Quelltext bearbeiten]
Der ISOALKY-Prozess dient der Herstellung von Alkylat, welches auf Grund seiner hohen Octanzahl in Treibstoffen verwendet wird. Dabei ersetzt eine ionische Flüssigkeit die gängigen sauren Katalysatoren Schwefelsäure und Flusssäure. Bei der ionischen Flüssigkeiten handelt es sich um ein Chlorid-Salz, das mit Aluminiumtrichlorid, sowie einer geringen Menge Chlorwasserstoff versetzt wird. So bildet sich eine katalytisch aktive Supersäure. Die exakte Zusammensetzung ist nicht öffentlich. Als Kation sind Pyridinium- und Imidazolium-Strukturen patentiert.[92] Ein möglicher Katalysator wäre z. B. das 1-Butyl-3-methylimidazoliumtetrachloroaluminat, das aus 1-Butyl-3-methylimidazoliumchlorid und Aluminiumtrichlorid gewonnen werden kann.[93]
Ionische Verdichter
[Bearbeiten | Quelltext bearbeiten]Bei ionischen Verdichtern handelt es sich um Verdrängungskompressoren, deren Hauptanwendungsgebiet in der Wasserstoffverdichtung liegt. Ionische Flüssigkeiten ersetzen dabei den sonst festen Kolben, wodurch weniger bewegliche Teile eingesetzt werden müssen, was letztlich zu Energieeinsparungen führt. Außerdem vereinfacht sich der Aufbau des Kompressors bedingt durch die geringe Löslichkeit von Wasserstoff in den eingesetzten ionischen Flüssigkeiten.[26][94] Die Linde Gruppe ist ein Vorreiter auf diesem Gebiet und konnte einen ionischen Verdichter, der Drücke zwischen 45 und 90 MPa und eine Kapazität von 8–30 kg h−1 erreicht, designen.[94] Vor allem Imidazolium-basierte ionische Flüssigkeiten werden in diesem Anwendungsfeld untersucht.[95][96]
Energetische ionische Flüssigkeiten
[Bearbeiten | Quelltext bearbeiten]
Energetische ionische Flüssigkeiten (EIL) werden als Alternativen für Treibstoffe und Explosivstoffe in Betracht gezogen. Dabei werden hochenergetische Anionen und Kationen kombiniert. In energetischen ionischen Flüssigkeiten werden unter anderen Imidazolium, Triazolium, Tetrazolium und quartäre Ammoniumverbindungen als Kationen eingesetzt, als Anionen beispielsweise Azide, Tretrazolate, Picrate, Nitrate oder Azolate. Hypergole ionische Flüssigkeiten enthalten z. B. Dicyanamid, Nitrocyanamid, komplexe Aluminium-Anionen, Hypophosphit und Bor-basierte Ionen, insbesondere solche, die reich an B-H-Bindungen sind.[38] Erste ionische Flüssigkeiten mit hypergolen Eigenschaften wurden 2008 publiziert. Dabei wurden Dicyanamid-Anionen verwendet.[98][99]
Umweltbilanz
[Bearbeiten | Quelltext bearbeiten]Ionische Flüssigkeiten werden häufig als „grüne“ Alternativen zu organischen Lösungsmitteln bezeichnet. Dies liegt vor allem an ihrer hohen thermischen Stabilität sowie ihrem geringen Dampfdruck. Somit können sie nicht in die Atmosphäre gelangen, wo sie Smog bilden, die Ozonschicht angreifen oder zur globalen Erwärmung beitragen könnten. Eine Exposition auf Mensch und Umwelt ist über die Luft nahezu ausgeschlossen, jedoch stellt die Anreichung schädlicher Substanzen in der Umwelt eine Gefahr dar. Aufgrund der großen Zahl an Kombinationsmöglichkeiten wird damit gerechnet, mittelfristig die gewünschten physikalisch-chemischen Eigenschaften bei möglichst geringer Toxizität zu erzielen.[100][101][102] Eine weitere Gefahr, die von organischen Lösungsmitteln ausgeht, ist die Bildung von explosionsfähigen Luftgemischen. Dieses Sicherheitsrisiko besteht bei ionischen Flüssigkeiten ebenfalls nicht.[103]
Toxikologie
[Bearbeiten | Quelltext bearbeiten]Während kaum Gefahr durch das Verdampfen von ionischen Flüssigkeiten ausgeht, muss die Löslichkeit in Wasser und somit seine Kontamination berücksichtigt werden, weshalb die langfristigen Umweltauswirkungen ionischer Flüssigkeiten noch untersucht werden. So wird die Toxikologie von ionischen Flüssigkeiten zunehmend untersucht. Ein besonderer Fokus liegt dabei auf aquatischen Lebewesen, aber auch Mikroorganismen, der Fadenwurm Caenorhabditis elegans, die Spitze Blasenschnecke (Physella acuta), Ratten und Zebrafische (Danio rerio) wurden untersucht.[101][103] Die fehlende Photoabbaubarkeit von Imidazolium-basierten ionischen Flüssigkeiten führt dazu, dass diese sich in Gewässern akkumulieren können, da die Bioabbaubarkeit sehr gering ist.[103][104] Systemische Untersuchungen wurden z. B. an Daphnia durchgeführt. Dabei konnte beobachtet werden, dass längere Alkylketten im Kation zu einer höheren Toxizität führen. Dieser Trend konnte sowohl für Imidazolium-, Pyridinium-, Ammonium- als auch Phosphonium-ionische Flüssigkeiten festgestellt werden. Die Wirkung der Anionen auf Daphnia folgt keinem klaren Trend, verglichen mit dem Natriumsalz des entsprechenden Anions ist die ionische Flüssigkeit immer toxischer.[101][105][106] Die Bakterie Lactobacillus zeigt in Gegenwart der ionischen Flüssigkeiten [BMIM][PF6], [HMIM][PF6] und [OMIM][PF6] eine geringere Aktivität bei der Milchsäureproduktion. Hier ist der Trend ersichtlich, dass längere Alkylketten einen größeren, negativen Einfluss haben.[101][107] Längere Alkylketten steigern die Lipophilie, wodurch amphiphile Moleküle entstehen können, die sich in die Doppellipidschicht von Zellmembranen einlagern, was als Ursache für den beobachteten Zusammenhang zwischen Alkylkettenlänge und Toxizität angenommen wird.[101]
Bioabbaubarkeit
[Bearbeiten | Quelltext bearbeiten]Umweltbedenklich sind halogenhaltige ionische Flüssigkeiten ebenso wie halogenierte organische Substanzen, da sie lange in der Umwelt bestehen und schon durch geringe Energiezufuhr (Licht oder Wärme) – ggf. noch erleichtert durch Enzyme – reaktive Zwischenstufen wie Radikale bilden, die in der Atmosphäre wie auch im Körper gleichermaßen schädlich sind.[108] Aufgrund der Toxizität und der potentiellen Akkumulation in der Umwelt wird die Bioabbaubarkeit von ionischen Flüssigkeiten unter verschiedenen Bedingungen untersucht. Verschiedene Methylimidazolium-, Pyridinium- und Dimethylaminopyridinium-Verbindungen wurden unter aeroben Bedingungen untersucht. Kationen mit kleinen Alkylketten zeigen keine Bioabbaubarkeit nach 31 Tagen, während lange Alkylketten (ab C8 für Methylimidazolium- und Pyridinium-Kationen, ab C6 für Dimethylaminopyridinium-Kationen) zu vollständiger Bioabbaubarkeit innerhalb von 31 Tagen führen.[109] Als Abbauweg für [OMIM]Cl wird zunächst eine Oxidation des terminalen Kohlenstoffatoms durch eine Monooxygenase angenommen. Das dabei entstehende 1-(8-Hydroxyoctyl)-3-methylimidazolium-Kation wird weiter zur Carbonsäure oxidiert. Durch β-Oxidation kann die Alkylkette sukzessive verkürzt werden, bis das finale Abbauprodukt 3-(3-Carboxypropyl)-1-methylimidazoliumchlorid entsteht.[109][110] Unter anaeroben Bedingungen kann die initiale Oxidation durch die Monooxygenase nicht stattfinden, was dazu führt, dass die ionischen Flüssigkeiten unter Sauerstoffausschluss nicht abbaubar sind. Dies kann umgangen werden, indem statt einer Octylkette eine 8-Hydroxyoctylkette am Imidazoliumkation installiert wird.[110]
Bakterien aus der Ordnung Sphingomonadales S. paucimobilis zeigen gute Ergebnisse beim Abbau von ionischen Flüssigkeiten. Von 37 untersuchten Substanzen konnten 20 innerhalb von 28 Tagen zu über 60 % abgebaut werden. Hierbei konnten zwei Trends festgestellt werden: Das Anion hat einen Einfluss auf die Bioabbaubarkeit, die in der Reihe PF6−, BF4−, Br−, Cl− sinkt. Im Kation führen kleinere Alkylreste zu besserer Abbaubarkeit. Außerdem ist das Bakterium in der Lage, die vormals als problematisch betrachteten ionischen Flüssigkeiten [BMIM][NTf2] und [BMIM][PF6] abzubauen.[111]
Corynebacterium zeigt gute Ergebnisse beim Abbau von Pyridinium-basierten ionischen Flüssigkeiten, während es [BMIM][PF6] nicht abbauen kann.[112]
In einer Studie über den Abbau von [OMIM]Cl wurden verschiedene Bakterienstämme aus den Familien Flavobacteriaceae, Micrococcaceae, Shewanellaceae, Moraxellaceae, Microbacteriaceae und Nocardiaceae untersucht. Die einzelnen Bakterienstämme waren kaum in der Lage, [OMIM]Cl abzubauen (≤ 8 %) und auch eine Kombination aus allen neun untersuchten Stämmen konnte nur einen Abbau von 30 % erreichen. Bei einer Konzentration der ionischen Flüssigkeit von 2 mᴍ wurde außerdem ein inhibiertes Wachstum der Bakterienstämme von durchschnittlich 40 % beobachtet.[113]
Biokompatibilität
[Bearbeiten | Quelltext bearbeiten]Die Bioabbaubarkeit von Anion und Kation kann nicht getrennt voneinander betrachtet werden, jedoch zeigen einige Strukturen in Kombination bessere Resultate. Dabei sind vor allem gut verfügbare Biomaterialien in den Fokus der Forschung gerückt. Ionische Flüssigkeiten, die sowohl aus Biomaterialien aufgebaut sind als auch eine gute Bioabbaubarkeit zeigen, werden biokompatibel genannt.[114]
Hydroxyethanol-Kationen und Formiate sowie simple Carboxylate zeigen gute Bioabbaubarkeit.[115] Auch Malonate, Succinate, Tartrate und Zucker-basierte Säuren zeigen, kombiniert mit bestimmten Kationen, gute Bioabbaubarkeit. Tetrabutylphosphonium als Kation führt zu schlechten Bioabbaubarkeiten, der Ersatz von zwei Butylresten durch Methylgruppen führt zu guten Abbaubarkeiten.[116] Auch die Kombination von Cholin mit Aminosäure-basierten Anionen führt zu abbaubaren ionischen Flüssigkeiten.[117]
Weblinks
[Bearbeiten | Quelltext bearbeiten]Literatur
[Bearbeiten | Quelltext bearbeiten]Bücher
[Bearbeiten | Quelltext bearbeiten]- Michael Freemantle: An Introduction to ionic liquids. RSC Pub, Cambridge, UK 2010, ISBN 978-1-84755-161-0.
- Peter Wasserscheid, T. Welton: Ionic liquids in synthesis. Wiley-VCH, Weinheim 2003, ISBN 3-527-60544-4.
Reviews
[Bearbeiten | Quelltext bearbeiten]- Sandip K. Singh, Anthony W. Savoy: Ionic liquids synthesis and applications: An overview. In: Journal of Molecular Liquids. Band 297, 2020, S. 112038, doi:10.1016/j.molliq.2019.112038.
- Tom Welton: Ionic liquids: a brief history. In: Biophysical Reviews. Band 10, 2018, S. 691–706, doi:10.1007/s12551-018-0419-2.
- John S. Wilkes: A short history of ionic liquids—from molten salts to neoteric solvents. In: Green Chemistry. Band 4, Nr. 2, 16. April 2002, S. 73–80, doi:10.1039/b110838g.
- Adam J. Greer, Johan Jacquemin, Christopher Hardacre: Industrial Applications of Ionic Liquids. In: Molecules. Band 25, Nr. 21, 9. November 2020, doi:10.3390/molecules25215207.
- Paul Nancarrow, Hanin Mohammed: Ionic Liquids in Space Technology - Current and Future Trends. In: ChemBioEng Reviews. Band 4, Nr. 2, April 2017, doi:10.1002/cben.201600021.
- Qinghua Zhang, Jean’ne M. Shreeve: Energetic Ionic Liquids as Explosives and Propellant Fuels: A New Journey of Ionic Liquid Chemistry. In: Chemical Reviews. Band 114, Nr. 20, 22. Oktober 2014, doi:10.1021/cr500364t.
- Masayoshi Watanabe, Morgan L. Thomas, Shiguo Zhang, Kazuhide Ueno, Tomohiro Yasuda: Application of Ionic Liquids to Energy Storage and Conversion Materials and Devices. In: Chemical Reviews. Band 117, Nr. 10, 24. Mai 2017, doi:10.1021/acs.chemrev.6b00504.
- Yansong Zhao, Tobias Bostrom: Application of Ionic Liquids in Solar Cells and Batteries: A Review. In: Current Organic Chemistry. Band 19, Nr. 6, 17. April 2015, doi:10.2174/1385272819666150127002529.
- Tamar L. Greaves, Calum J. Drummond: Protic Ionic Liquids: Properties and Applications. In: Chemical Reviews. Band 108, Nr. 1, Januar 2008, doi:10.1021/cr068040u.
- Fred van Rantwijk, Roger A. Sheldon: Biocatalysis in Ionic Liquids. In: Chemical Reviews. Band 107, Nr. 6, Juni 2007, doi:10.1021/cr050946x.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Christopher P. Fredlake, Jacob M. Crosthwaite, Daniel G. Hert, Sudhir N. V. K. Aki, Joan F. Brennecke: Thermophysical Properties of Imidazolium-Based Ionic Liquids. In: Journal of Chemical & Engineering Data. Band 49, Nr. 4, Juli 2004, S. 954–964, doi:10.1021/je034261a.
- ↑ a b c Michael Freemantle: An Introduction to ionic liquids. RSC Pub, Cambridge, UK 2010, ISBN 978-1-84755-161-0, S. 8–10.
- ↑ a b c Ana P.M. Tavares, Oscar Rodriguez, Eugenia A. Macedo: New Generations of Ionic Liquids Applied to Enzymatic Biocatalysis. In: Ionic Liquids - New Aspects for the Future. InTech, 2013, ISBN 978-953-510-937-2, doi:10.5772/51897.
- ↑ a b William Ramsay: XXXIV. On picoline and its derivatives. In: The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science. Band 2, Nr. 11, Oktober 1876, S. 269–281, doi:10.1080/14786447608639105.
- ↑ a b c d Paul Murrill: HALIDES AND PERHALIDES OF THE PICOLINES. In: Journal of the American Chemical Society. Band 21, Nr. 10, Oktober 1899, S. 828–854, doi:10.1021/ja02060a002.
- ↑ Gerhard Laus, Gino Bentivoglio, Herwig Schottenberger, Volker Kahlenberg, Holge Kopacka, Thomas Röder, Herbert Sixta: Ionic liquids: Current developments, potential and drawbacks for industrial applications. In: Lenzinger Berichte. Band 84, 2005, S. 71–85.
- ↑ a b c d Juliusz Pernak, Tomasz Rzemieniecki, Katarzyna Materna: Ionic liquids „in a nutshell“ (history, properties and development). In: CHEMIK. Band 70, Nr. 9, 2016, S. 471–480.
- ↑ a b c d John S. Wilkes: A short history of ionic liquids—from molten salts to neoteric solvents. In: Green Chemistry. Band 4, Nr. 2, 16. April 2002, S. 73–80, doi:10.1039/b110838g.
- ↑ C. Friedel, J. M. Crafts: Sur une nouvelle méthode générale de synthèse d’hydrocarbures, d’acétones, etc. In: Compt. Rend. Band 84, 1877, S. 1392, S. 1450.
- ↑ S. Gabriel, J. Weiner: Ueber Vinylamin und Bromäthylamin. In: Berichte der deutschen chemischen Gesellschaft. Band 21, Nr. 2, Juli 1888, S. 2664–2669, doi:10.1002/cber.18880210287.
- ↑ Tom Welton: Ionic liquids: a brief history. In: Biophysical Reviews. Band 10, Nr. 3, Juni 2018, S. 691–706, doi:10.1007/s12551-018-0419-2, PMID 29700779, PMC 5988633 (freier Volltext).
- ↑ a b P. Walden In: Bull. Acad. Sci. St. Petersburg. 1914, S. 405–422.
- ↑ Samuel Sugden, Henry Wilkins: CLXVII.—The parachor and chemical constitution. Part XII. Fused metals and salts. In: J. Chem. Soc. Band 0, Nr. 0, 1929, S. 1291–1298, doi:10.1039/JR9290001291.
- ↑ a b Frank H. Hurley, Thomas P. Wier: Electrodeposition of Metals from Fused Quaternary Ammonium Salts. In: Journal of The Electrochemical Society. Band 98, Nr. 5, 1951, S. 203, doi:10.1149/1.2778132.
- ↑ John T. Yoke, Joseph F. Weiss, Gordon Tollin: Reactions of Triethylamine with Copper(I) and Copper(II) Halides. In: Inorganic Chemistry. Band 2, Nr. 6, Dezember 1963, S. 1210–1216, doi:10.1021/ic50010a028.
- ↑ Nathan Kornblum, Gerald P. Coffey: The Reaction of Triethyloxonium Fluoroborate with the Sodium Salt of α-Pyridone 1. In: The Journal of Organic Chemistry. Band 31, Nr. 10, Oktober 1966, S. 3449–3451, doi:10.1021/jo01348a536.
- ↑ George W. Parshall: Catalysis in molten salt media. In: Journal of the American Chemical Society. Band 94, Nr. 25, Dezember 1972, S. 8716–8719, doi:10.1021/ja00780a013.
- ↑ R. J. Gale, B. Gilbert, R. A. Osteryoung: Raman spectra of molten aluminum chloride: 1-butylpyridinium chloride systems at ambient temperatures. In: Inorganic Chemistry. Band 17, Nr. 10, 1. Oktober 1978, S. 2728–2729, doi:10.1021/ic50188a008.
- ↑ Patent US4122245A: AlCl3 /1-alkyl pyridinium chloride room temperature electrolytes. Veröffentlicht am 24. Oktober 1978, Erfinder: John C. Nardi, Charles L. Hussey, Lowell A. King.
- ↑ John S. Wilkes, Joseph A. Levisky, Robert A. Wilson, Charles L. Hussey: Dialkylimidazolium chloroaluminate melts: a new class of room-temperature ionic liquids for electrochemistry, spectroscopy and synthesis. In: Inorganic Chemistry. Band 21, Nr. 3, März 1982, S. 1263–1264, doi:10.1021/ic00133a078.
- ↑ Towner B. Scheffler, Charles L. Hussey, Kenneth R. Seddon, Christopher M. Kear, Phillip D. Armitage: Molybdenum chloro complexes in room-temperature chloroaluminate ionic liquids: stabilization of hexachloromolybdate(2-) and hexachloromolybdate(3-). In: Inorganic Chemistry. Band 22, Nr. 15, Juli 1983, S. 2099–2100, doi:10.1021/ic00157a001.
- ↑ Slaton E. Fry, Norbert J. Pienta: Effects of molten salts on reactions. Nucleophilic aromatic substitution by halide ions in molten dodecyltributylphosphonium salts. In: Journal of the American Chemical Society. Band 107, Nr. 22, Oktober 1985, S. 6399–6400, doi:10.1021/ja00308a045.
- ↑ Jeffrey A. Boon, Joseph A. Levisky, J. Lloyd Pflug, John S. Wilkes: Friedel-Crafts reactions in ambient-temperature molten salts. In: The Journal of Organic Chemistry. Band 51, Nr. 4, Februar 1986, S. 480–483, doi:10.1021/jo00354a013.
- ↑ a b John S. Wilkes, Michael J. Zaworotko: Air and water stable 1-ethyl-3-methylimidazolium based ionic liquids. In: Journal of the Chemical Society, Chemical Communications. Nr. 13, 1992, S. 965, doi:10.1039/c39920000965.
- ↑ Pierre Bonhôte, Ana-Paula Dias, Nicholas Papageorgiou, Kuppuswamy Kalyanasundaram, Michael Grätzel: Hydrophobic, Highly Conductive Ambient-Temperature Molten Salts †. In: Inorganic Chemistry. Band 35, Nr. 5, Januar 1996, S. 1168–1178, doi:10.1021/ic951325x.
- ↑ a b c d e f G. Wytze Meindersma, Matthias Maase, André B. De Haan: Ionic Liquids. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, Germany 2007, ISBN 978-3-527-30673-2, S. 547–575, doi:10.1002/14356007.l14_l01.
- ↑ a b c d Peter Wasserscheid, Wilhelm Keim: Ionic Liquids—New “Solutions” for Transition Metal Catalysis. In: Angewandte Chemie International Edition. Band 39, Nr. 21, 2000, S. 3772–3789, doi:10.1002/1521-3773(20001103)39:213.0.CO;2-5.
- ↑ a b c d e Peter Wasserscheid, T. Welton: Ionic liquids in synthesis. Wiley-VCH, Weinheim 2003, ISBN 3-527-60544-4, S. 7–21.
- ↑ Datenblatt 1-Butyl-3-methyl-imidazolium-chlorid (PDF) bei Carl Roth, abgerufen am 21. März 2021.
- ↑ Sanhu Zhao, Xiaoming Xu, Lu Zheng, Hai Liu: An efficient ultrasonic-assisted synthesis of imidazolium and pyridinium salts based on the Zincke reaction. In: Ultrasonics Sonochemistry. Band 17, Nr. 4, 2010, S. 685–689, doi:10.1016/j.ultsonch.2009.12.019.
- ↑ Julio Cezar Pastre, Carlos Roque D. Correia, Yves Génisson: Non-occurrence of a Zincke-like process upon treatment of 1-(2,4-dinitrophenyl)-3-methylimidazolium chloride with a chiral primary amine. In: Green Chemistry. Band 10, Nr. 8, 2008, S. 885–889, doi:10.1039/B804650F.
- ↑ Joan Fuller, Richard T. Carlin, Hugh C. De Long, Dustin Haworth: Structure of 1-ethyl-3-methylimidazolium hexafluorophosphate: model for room temperature molten salts. In: Journal of the Chemical Society, Chemical Communications. Nr. 3, 1994, S. 299, doi:10.1039/c39940000299.
- ↑ Immaculada Dinarès, Cristina Garcia de Miguel, Anna Ibáñez, Neus Mesquida, Ermitas Alcalde: Imidazolium ionic liquids: A simple anion exchange protocol. In: Green Chemistry. Band 11, Nr. 10, 2009, S. 1507, doi:10.1039/b915743n.
- ↑ a b Tamar L. Greaves, Calum J. Drummond: Protic Ionic Liquids: Properties and Applications. In: Chemical Reviews. Band 108, Nr. 1, Januar 2008, S. 206–237, doi:10.1021/cr068040u.
- ↑ a b c Sandip K. Singh, Anthony W. Savoy: Ionic liquids synthesis and applications: An overview. In: Journal of Molecular Liquids. Band 297, 2020, S. 112038, doi:10.1016/j.molliq.2019.112038.
- ↑ a b c d Adam J. Greer, Johan Jacquemin, Christopher Hardacre: Industrial Applications of Ionic Liquids. In: Molecules. Band 25, Nr. 21, 9. November 2020, S. 5207, doi:10.3390/molecules25215207, PMID 33182328, PMC 7664896 (freier Volltext).
- ↑ Paul Nancarrow, Hanin Mohammed: Ionic Liquids in Space Technology - Current and Future Trends. In: ChemBioEng Reviews. Band 4, Nr. 2, April 2017, S. 106–119, doi:10.1002/cben.201600021.
- ↑ a b Qinghua Zhang, Jean’ne M. Shreeve: Energetic Ionic Liquids as Explosives and Propellant Fuels: A New Journey of Ionic Liquid Chemistry. In: Chemical Reviews. Band 114, Nr. 20, 22. Oktober 2014, S. 10527–10574, doi:10.1021/cr500364t.
- ↑ Masayoshi Watanabe, Morgan L. Thomas, Shiguo Zhang, Kazuhide Ueno, Tomohiro Yasuda: Application of Ionic Liquids to Energy Storage and Conversion Materials and Devices. In: Chemical Reviews. Band 117, Nr. 10, 24. Mai 2017, S. 7190–7239, doi:10.1021/acs.chemrev.6b00504.
- ↑ Yansong Zhao, Tobias Bostrom: Application of Ionic Liquids in Solar Cells and Batteries: A Review. In: Current Organic Chemistry. Band 19, Nr. 6, 17. April 2015, S. 556–566, doi:10.2174/1385272819666150127002529.
- ↑ Md. Iqbal Hossain, G. J. Blanchard: Ionic Liquids Exhibit the Piezoelectric Effect. In: The Journal of Physical Chemistry Letters. Band 14, Nr. 11, 23. März 2023, ISSN 1948-7185, S. 2731–2735, doi:10.1021/acs.jpclett.3c00329.
- ↑ a b c Peter Wasserscheid, T. Welton: Ionic liquids in synthesis. Wiley-VCH, Weinheim 2003, ISBN 3-527-60544-4, S. 41–55.
- ↑ a b Pamela M. Dean, Jennifer M. Pringle, Douglas R. MacFarlane: Structural analysis of low melting organic salts: perspectives on ionic liquids. In: Physical Chemistry Chemical Physics. Band 12, Nr. 32, 2010, S. 9144, doi:10.1039/c003519j.
- ↑ John D. Holbrey, W. Matthew Reichert, Mark Nieuwenhuyzen, Suzanne Johnson, Kenneth R. Seddon, Robin D. Rogers: Crystal polymorphism in 1-butyl-3-methylimidazolium halides: supporting ionic liquid formation by inhibition of crystallization. In: Chemical Communications. Nr. 14, 2003, S. 1636–1637, doi:10.1039/B304543A.
- ↑ a b c Satoshi Hayashi, Ryosuke Ozawa, Hiro-o Hamaguchi: Raman Spectra, Crystal Polymorphism, and Structure of a Prototype Ionic-liquid [bmim]Cl. In: Chemistry Letters. Band 32, Nr. 6, 2003, S. 498–499, doi:10.1246/cl.2003.498.
- ↑ Hiro-o Hamaguchi, Ryosuke Ozawa: Advances in Chemical Physics. John Wiley & Sons, Ltd, 2005, ISBN 978-0-471-73946-3, Structure of Ionic Liquids and Ionic Liquid Compounds: Are Ionic Liquids Genuine Liquids in the Conventional Sense?, S. 85–104, doi:10.1002/0471739464.ch3.
- ↑ a b Karina Shimizu, Margarida F. Costa Gomes, Agílio A. H. Pádua, Luís P. N. Rebelo, José N. Canongia Lopes: Three commentaries on the nano-segregated structure of ionic liquids. In: Journal of Molecular Structure: THEOCHEM. Band 946, Nr. 1, 2010, S. 70–76, doi:10.1016/j.theochem.2009.11.034.
- ↑ Marijana Blesic, Małgorzata Swadźba-Kwaśny, John D. Holbrey, José N. Canongia Lopes, Kenneth R. Seddon, Luís Paulo N. Rebelo: New catanionic surfactants based on 1-alkyl-3-methylimidazolium alkylsulfonates, [CnH2n+1mim][CmH2m+1SO3]: mesomorphism and aggregation. In: Physical Chemistry Chemical Physics. Band 11, Nr. 21, 2009, S. 4260–4268, doi:10.1039/B822341F.
- ↑ Alexander M. Smith, Kevin R. J. Lovelock, Nitya Nand Gosvami, Peter Licence, Andrew Dolan, Tom Welton, Susan Perkin: Monolayer to Bilayer Structural Transition in Confined Pyrrolidinium-Based Ionic Liquids. In: The Journal of Physical Chemistry Letters. Band 4, Nr. 3, 2013, S. 378–382, doi:10.1021/jz301965d.
- ↑ R. Blossey, A. C. Maggs, R. Podgornik: Structural interactions in ionic liquids linked to higher-order Poisson-Boltzmann equations. In: Physical Review E. Band 95, Nr. 6, 2017, S. 060602, doi:10.1103/PhysRevE.95.060602.
- ↑ Ryosuke Ozawa, Satoshi Hayashi, Satyen Saha, Akiko Kobayashi, Hiro-o Hamaguchi: Rotational Isomerism and Structure of the 1-Butyl-3-methylimidazolium Cation in the Ionic Liquid State. In: Chemistry Letters. Band 32, Nr. 10, 2003, S. 948–949, doi:10.1246/cl.2003.948.
- ↑ a b c Sankaran Murugesan, Oliver A. Quintero, Brendan P. Chou, Penghao Xiao, Kyusung Park: Wide electrochemical window ionic salt for use in electropositive metal electrodeposition and solid state Li-ion batteries. In: J. Mater. Chem. A. Band 2, Nr. 7, 2014, S. 2194–2201, doi:10.1039/C3TA15010K.
- ↑ a b c Peter Wasserscheid, T. Welton: Ionic liquids in synthesis. Wiley-VCH, Weinheim 2003, ISBN 3-527-60544-4, S. 103–126.
- ↑ Eleanor D. Bates, Rebecca D. Mayton, Ioanna Ntai, James H. Davis: CO2 Capture by a Task-Specific Ionic Liquid. In: Journal of the American Chemical Society. Band 124, Nr. 6, 2002, S. 926–927, doi:10.1021/ja017593d.
- ↑ Tatjana Heckel, Andreas Winkel, René Wilhelm: Chiral ionic liquids based on nicotine for the chiral recognition of carboxylic acids. In: Tetrahedron: Asymmetry. Band 24, Nr. 18, 2013, S. 1127–1133, doi:10.1016/j.tetasy.2013.07.021.
- ↑ Zhichang Liu, Pengcheng Hu, Xianghai Meng, Rui Zhang, Huiqing Yue, Chunming Xu, Yufeng Hu: Synthesis and properties of switchable polarity ionic liquids based on organic superbases and fluoroalcohols. In: Chemical Engineering Science. Band 108, 2014, S. 176–182, doi:10.1016/j.ces.2013.12.040.
- ↑ Suqin Hu, Tao Jiang, Zhaofu Zhang, Anlian Zhu, Buxing Han, Jinliang Song, Ye Xie, Wenjing Li: Functional ionic liquid from biorenewable materials: synthesis and application as a catalyst in direct aldol reactions. In: Tetrahedron Letters. Band 48, Nr. 32, 2007, S. 5613–5617, doi:10.1016/j.tetlet.2007.06.051.
- ↑ Yajnaseni Biswas, Palash Banerjee, Tarun K. Mandal: From Polymerizable Ionic Liquids to Poly(ionic liquid)s: Structure-Dependent Thermal, Crystalline, Conductivity, and Solution Thermoresponsive Behaviors. In: Macromolecules. Band 52, Nr. 3, 2019, S. 945–958, doi:10.1021/acs.macromol.8b02351.
- ↑ Qiu-Han Lin, Yu-Chuan Li, Ya-Yu Li, Zhu Wang, Wei Liu, Cai Qi, Si-Ping Pang: Energetic salts based on 1-amino-1,2,3-triazole and 3-methyl-1-amino-1,2,3-triazole. In: Journal of Materials Chemistry. Band 22, Nr. 2, 2011, S. 666–674, doi:10.1039/C1JM14322K.
- ↑ Zhiying Duan, Yanlong Gu, Youquan Deng: Neutral ionic liquid [BMIm]BF4 promoted highly selective esterification of tertiary alcohols by acetic anhydride. In: Journal of Molecular Catalysis A: Chemical. Band 246, Nr. 1, 2006, S. 70–75, doi:10.1016/j.molcata.2005.10.017.
- ↑ Maren Muntzeck, René Wilhelm: Protic ionic liquids as catalysts for a three-component coupling/hydroarylation/dehydrogenation tandem reaction. In: Zeitschrift für Naturforschung B. Band 73, Nr. 7, 2018, S. 515–519, doi:10.1515/znb-2018-0084.
- ↑ Zhenyou Gui, Nanette Zahrtmann, Shunmugavel Saravanamurugan, Ines Reyero, Zhiwen Qi, Miguel A. Bañares, Anders Riisager, Eduardo J. Garcia-Suarez: Brønsted Acid Ionic Liquids (BAILs) as Efficient and Recyclable Catalysts in the Conversion of Glycerol to Solketal at Room Temperature. In: ChemistrySelect. Band 1, Nr. 18, 2016, S. 5869–5873, doi:10.1002/slct.201601600.
- ↑ Masahiro Yoshizawa-Fujita, Douglas R. MacFarlane, Patrick C. Howlett, Maria Forsyth: A new Lewis-base ionic liquid comprising a mono-charged diamine structure: A highly stable electrolyte for lithium electrochemistry. In: Electrochemistry Communications. Band 8, Nr. 3, 2006, S. 445–449, doi:10.1016/j.elecom.2006.01.008.
- ↑ A. Bösmann, L. Datsevich, A. Jess, A. Lauter, C. Schmitz, P. Wasserscheid: Deep desulfurization of diesel fuel by extraction with ionic liquids. In: Chemical Communications. Nr. 23, 2001, S. 2494–2495, doi:10.1039/B108411A.
- ↑ Carmela Aprile, Francesco Giacalone, Michelangelo Gruttadauria, Adriana Mossuto Marculescu, Renato Noto, Jefferson D. Revell, Helma Wennemers: New ionic liquid-modified silica gels as recyclable materials for L-proline- or H–Pro–Pro–Asp–NH2-catalyzed aldol reaction. In: Green Chemistry. Band 9, Nr. 12, 2007, S. 1328–1334, doi:10.1039/B709471J.
- ↑ a b Fred van Rantwijk, Roger A. Sheldon: Biocatalysis in Ionic Liquids. In: Chemical Reviews. Band 107, Nr. 6, Juni 2007, S. 2757–2785, doi:10.1021/cr050946x.
- ↑ a b Christoph Roosen, Pia Müller, Lasse Greiner: Ionic liquids in biotechnology: applications and perspectives for biotransformations. In: Applied Microbiology and Biotechnology. Band 81, Nr. 4, Dezember 2008, S. 607–614, doi:10.1007/s00253-008-1730-9, PMID 18979095, PMC 7419490 (freier Volltext).
- ↑ Thomas Waldmann, Hsin-Hui Huang, Harry E. Hoster, Oliver Höfft, Frank Endres: Imaging an Ionic Liquid Adlayer by Scanning Tunneling Microscopy at the Solid|Vacuum Interface. In: ChemPhysChem. Band 12, Nr. 14, 4. Oktober 2011, S. 2565–2567, doi:10.1002/cphc.201100413.
- ↑ Martina B. Hanel, Andreas Filzwieser, Iris Filzwieser, Stefan Ruhs: ILTEC - METTOP’S REVOLUTIONARY COOLING SOLUTION FOR THE STEEL INDUSTRY. (PDF) Abgerufen am 9. April 2019 (englisch).
- ↑ a b U. Vagt: Ionische Flüssigkeiten – Einzigartige Materialien mit vielfältigen Möglichkeiten. In: CHEManager. 22/2008, S. 19.
- ↑ Wu Xu, Xilin Chen, Fei Ding, Jie Xiao, Deyu Wang: Reinvestigation on the state-of-the-art nonaqueous carbonate electrolytes for 5 V Li-ion battery applications. In: Journal of Power Sources. Band 213, September 2012, S. 304–316, doi:10.1016/j.jpowsour.2012.04.031.
- ↑ Michel Armand, Frank Endres, Douglas R. MacFarlane, Hiroyuki Ohno, Bruno Scrosati: Ionic-liquid materials for the electrochemical challenges of the future. In: Nature Materials. Band 8, Nr. 8, August 2009, S. 621–629, doi:10.1038/nmat2448.
- ↑ A. Guerfi, M. Dontigny, P. Charest, M. Petitclerc, M. Lagacé: Improved electrolytes for Li-ion batteries: Mixtures of ionic liquid and organic electrolyte with enhanced safety and electrochemical performance. In: Journal of Power Sources. Band 195, Nr. 3, Februar 2010, S. 845–852, doi:10.1016/j.jpowsour.2009.08.056.
- ↑ Richard P. Swatloski, Scott K. Spear, John D. Holbrey, Robin D. Rogers: Dissolution of Cellose with Ionic Liquids. In: Journal of the American Chemical Society. Band 124/18, 2002, S. 4974–4975, doi:10.1021/ja025790m.
- ↑ Hao Zhang, Jin Wu, Jun Zhang, Jiasong He: 1-Allyl-3-methylimidazolium Chloride Room Temperature Ionic Liquid: A New and Powerful Nonderivatizing Solvent for Cellulose. In: Macromolecules. Band 38, 2005, S. 8272–8277, doi:10.1021/ma0505676.
- ↑ Bin Zhao, Lasse Greiner, Walter Leitner: Cellulose solubilities in carboxylate-based ionic liquids. In: RSC Advances. Band 2, 2012, S. 2476–2479, doi:10.1039/C2RA01224C.
- ↑ Frank Hermanutz, Frank Gähr, Klemens Massonne, Eric Uerdingen: Oral presentation at the 45th Chemiefasertagung. Dornbirn, Österreich, 20.–22. September 2006.
- ↑ Y. Su, H. M. Brown, X. Huang, X. Zhou, J. E. Amonette, Z. C. Zhang: Single-step conversion of cellulose to 5-hydroxymethylfurfural (HMF), a versatile platform chemical. In: Appl. Catalysis. A 361, 2009, S. 117–122. doi:10.1016/j.apcata.2009.04.002
- ↑ Forum: Chem. Ing. Tech. 6/2009. In: Chemie Ingenieur Technik. Band 81, Nr. 6, 2009, S. 679, doi:10.1002/cite.200990045.
- ↑ a b c I. M. Marrucho, L. C. Branco, L. P. N. Rebelo: Ionic Liquids in Pharmaceutical Applications. In: Annual Review of Chemical and Biomolecular Engineering. Band 5, Nr. 1, 7. Juni 2014, S. 527–546, doi:10.1146/annurev-chembioeng-060713-040024.
- ↑ Jelena Stoimenovski, Douglas R. MacFarlane, Katharina Bica, Robin D. Rogers: Crystalline vs. Ionic Liquid Salt Forms of Active Pharmaceutical Ingredients: A Position Paper. In: Pharmaceutical Research. Band 27, Nr. 4, April 2010, S. 521–526, doi:10.1007/s11095-009-0030-0.
- ↑ a b Sónia N. Pedro, Carmen S. R. Freire, Armando J. D. Silvestre, Mara G. Freire: The Role of Ionic Liquids in the Pharmaceutical Field: An Overview of Relevant Applications. In: International Journal of Molecular Sciences. Band 21, Nr. 21, 5. November 2020, S. 8298, doi:10.3390/ijms21218298, PMID 33167474, PMC 7663996 (freier Volltext).
- ↑ Whitney L. Hough, Marcin Smiglak, Héctor Rodríguez, Richard P. Swatloski, Scott K. Spear: The third evolution of ionic liquids: active pharmaceutical ingredients. In: New Journal of Chemistry. Band 31, Nr. 8, 27. Juli 2007, S. 1429–1436, doi:10.1039/B706677P.
- ↑ J. Stoimenovski, D. R. MacFarlane, K. Bica, R. D. Rogers: Crystalline vs. Ionic Liquid Salt Forms of Active Pharmaceutical Ingredients: A Position Paper. In: Pharmaceutical Research. Band 27, 2010, S. 521–526, doi:10.1007/s11095-009-0030-0.
- ↑ Yasushi Miwa, Hidetoshi Hamamoto, Tatsuhiro Ishida: Lidocaine self-sacrificially improves the skin permeation of the acidic and poorly water-soluble drug etodolac via its transformation into an ionic liquid. In: European Journal of Pharmaceutics and Biopharmaceutics. Band 102, 2016, S. 92–100, doi:10.1016/j.ejpb.2016.03.003.
- ↑ Ksenia S. Egorova, Evgeniy G. Gordeev, Valentine P. Ananikov: Biological Activity of Ionic Liquids and Their Application in Pharmaceutics and Medicine. In: Chemical Reviews. Band 117, Nr. 10, 2017, S. 7132–7189, doi:10.1021/acs.chemrev.6b00562.
- ↑ a b c d Caroline Emilie Paul, Vicente Gotor Fernández: Biocatalysis and Biotransformation in Ionic Liquids. In: Ionic Liquids in Lipid Processing and Analysis. Elsevier, 2016, ISBN 978-1-63067-047-4, S. 11–58, doi:10.1016/b978-1-63067-047-4.00002-7.
- ↑ R. Madeira Lau, F. Van Rantwijk, K. R. Seddon, R. A. Sheldon: Lipase-Catalyzed Reactions in Ionic Liquids. In: Organic Letters. Band 2, Nr. 26, Dezember 2000, S. 4189–4191, doi:10.1021/ol006732d.
- ↑ Eduardo García-Verdugo, Belen Altava, M. Isabel Burguete, Pedro Lozano, S. V. Luis: Ionic liquids and continuous flow processes: a good marriage to design sustainable processes. In: Green Chemistry. Band 17, Nr. 5, 2015, S. 2693–2713, doi:10.1039/C4GC02388A.
- ↑ Matthias Maase, Klemens Massonne, Uwe Vagt: BASIL™—BASF’s Processes Based on Ionic Liquids. Abgerufen am 19. Januar 2022.
- ↑ Tom Welton: Solvents and sustainable chemistry. In: Proceedings of the Royal Society A: Mathematical, Physical and Engineering Sciences. Band 471, Nr. 2183, 8. November 2015, S. 20150502, doi:10.1098/rspa.2015.0502, PMID 26730217, PMC 4685879 (freier Volltext) – (englisch).
- ↑ Patent US7432409B2: Alkylation process using chloroaluminate ionic liquid catalysts. Veröffentlicht am 21. Dezember 2004, Erfinder: S. Elomari, S. Trumbull, H. K. C. Timken, R. Cleverdon.
- ↑ Hye Kyung Timken, Huping Luo, Bong-Kyu Chang, Elizabeth Carter, Matthew Cole: ISOALKY™ Technology: Next-Generation Alkylate Gasoline Manufacturing Process Technology Using Ionic Liquid Catalyst. In: Commercial Applications of Ionic Liquids. Springer International Publishing, Cham 2020, ISBN 978-3-03035244-8, S. 33–47, doi:10.1007/978-3-030-35245-5_2.
- ↑ a b Jiexin Zou, Ning Han, Jiangyan Yan, Qi Feng, Yajun Wang: Electrochemical Compression Technologies for High-Pressure Hydrogen: Current Status, Challenges and Perspective. In: Electrochemical Energy Reviews. Band 3, Nr. 4, Dezember 2020, S. 690–729, doi:10.1007/s41918-020-00077-0.
- ↑ Marzena Dzida, Małgorzata Musiał, Edward Zorębski, Sylwia Jężak, Justyna Skowronek: Comparative Study of the High Pressure Thermophysical Properties of 1-Ethyl-3-methylimidazolium and 1,3-Diethylimidazolium Ethyl Sulfates for Use as Sustainable and Efficient Hydraulic Fluids. In: ACS Sustainable Chemistry & Engineering. Band 6, Nr. 8, 6. August 2018, S. 10934–10943, doi:10.1021/acssuschemeng.8b02318.
- ↑ Nasrin Arjomand Kermani, Irina Petrushina, Aleksey Nikiforov, Jens Oluf Jensen, Masoud Rokni: Corrosion behavior of construction materials for ionic liquid hydrogen compressor. In: International Journal of Hydrogen Energy. Band 41, Nr. 38, Oktober 2016, S. 16688–16695, doi:10.1016/j.ijhydene.2016.06.221.
- ↑ Qiu-Han Lin, Yu-Chuan Li, Ya-Yu Li, Zhu Wang, Wei Liu: Energetic salts based on 1-amino-1,2,3-triazole and 3-methyl-1-amino-1,2,3-triazole. In: Journal of Materials Chemistry. Band 22, Nr. 2, 8. Dezember 2011, S. 666–674, doi:10.1039/C1JM14322K.
- ↑ Stefan Schneider, Tom Hawkins, Yonis Ahmed, Stephan Deplazes, Jeff Mills: Ionic Liquid Fuels for Chemical Propulsion. In: ACS Symposium Series. Band 1117. American Chemical Society, Washington, DC 2012, ISBN 978-0-8412-2763-7, S. 1–25, doi:10.1021/bk-2012-1117.ch001.
- ↑ Stefan Schneider, Tommy Hawkins, Michael Rosander, Ghanshyam Vaghjiani, Steven Chambreau: Ionic Liquids as Hypergolic Fuels. In: Energy & Fuels. Band 22, Nr. 4, 1. Juli 2008, S. 2871–2872, doi:10.1021/ef800286b.
- ↑ Thi Phuong Thuy Pham, Chul-Woong Cho, Yeoung-Sang Yun: Environmental fate and toxicity of ionic liquids: A review. In: Water Research. Band 44, Nr. 2, 2010, S. 352–372, doi:10.1016/j.watres.2009.09.030.
- ↑ a b c d e Dongbin Zhao, Yongcheng Liao, Ziding Zhang: Toxicity of Ionic Liquids. In: CLEAN – Soil, Air, Water. Band 35, Nr. 1, Februar 2007, S. 42–48, doi:10.1002/clen.200600015.
- ↑ Sónia P.M. Ventura, Carolina S. Marques, Andreia A. Rosatella, Carlos A.M. Afonso, Fernando Gonçalves: Toxicity assessment of various ionic liquid families towards Vibrio fischeri marine bacteria. In: Ecotoxicology and Environmental Safety. Band 76, Februar 2012, S. 162–168, doi:10.1016/j.ecoenv.2011.10.006.
- ↑ a b c Jolanta Flieger, Michał Flieger: Ionic Liquids Toxicity—Benefits and Threats. In: International Journal of Molecular Sciences. Band 21, Nr. 17, 29. August 2020, S. 6267, doi:10.3390/ijms21176267, PMID 32872533, PMC 7504185 (freier Volltext).
- ↑ N. Gathergood, P. J. Scammells: Design and Preparation of Room-Temperature Ionic Liquids Containing Biodegradable Side Chains. In: Australian Journal of Chemistry. Band 55, Nr. 9, 2002, S. 557, doi:10.1071/CH02148.
- ↑ Andrew S. Wells, Vyvyan T. Coombe: On the Freshwater Ecotoxicity and Biodegradation Properties of Some Common Ionic Liquids. In: Organic Process Research & Development. Band 10, Nr. 4, Juli 2006, S. 794–798, doi:10.1021/op060048i.
- ↑ Effect of Mineral-Organic-Microorganism Interactions on Soil and Freshwater Environments. Springer US, Boston, MA 1999, ISBN 978-1-4613-7120-5, doi:10.1007/978-1-4615-4683-2.
- ↑ Michiaki Matsumoto, Kenji Mochiduki, Kei Fukunishi, Kazuo Kondo: Extraction of organic acids using imidazolium-based ionic liquids and their toxicity to Lactobacillus rhamnosus. In: Separation and Purification Technology. Band 40, Nr. 1, November 2004, S. 97–101, doi:10.1016/j.seppur.2004.01.009.
- ↑ Jan C. Kuschnerow: Einsatz ionischer Fluide als Katalysator in der homogenen Reaktivdestillation unter Berücksichtigung reaktionskinetischer Aspekte. GRIN Verlag, 2011, ISBN 978-3-640-94255-8, S. 14 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b Stefan Stolte, Salha Abdulkarim, Jürgen Arning, Anne-Katrin Blomeyer-Nienstedt, Ulrike Bottin-Weber, Marianne Matzke, Johannes Ranke, Bernd Jastorff, Jorg Thöming: Primary biodegradation of ionic liquid cations, identification of degradation products of 1-methyl-3-octylimidazolium chloride and electrochemical wastewater treatment of poorly biodegradable compounds. In: Green Chemistry. Band 10, Nr. 2, 2008, S. 214–224, doi:10.1039/B713095C.
- ↑ a b Jennifer Neumann, Olav Grundmann, Jorg Thöming, Michael Schulte, Stefan Stolte: Anaerobic biodegradability of ionic liquid cations under denitrifying conditions. In: Green Chemistry. Band 12, Nr. 4, 2010, S. 620–627, doi:10.1039/B918453H.
- ↑ Concepcion Abrusci, Jose Palomar, Jesus L. Pablos, Francisco Rodriguez, Fernando Catalina: Efficient biodegradation of common ionic liquids by Sphingomonas paucimobilis bacterium. In: Green Chemistry. Band 13, Nr. 3, 2011, S. 709–717, doi:10.1039/C0GC00766H.
- ↑ C. Zhang, H. Wang, S. V. Malhotra, C. J. Dodge, A. J. Francis: Biodegradation of pyridinium-based ionic liquids by an axenic culture of soil Corynebacteria. In: Green Chemistry. Band 12, Nr. 5, 2010, S. 851–858, doi:10.1039/B924264C.
- ↑ M. Markiewicz, J. Henke, A. Brillowska-Dąbrowska, S. Stolte, J. Łuczak, C. Jungnickel: Bacterial consortium and axenic cultures isolated from activated sewage sludge for biodegradation of imidazolium-based ionic liquid. In: International Journal of Environmental Science and Technology. Band 11, Nr. 7, 2014, S. 1919–1926, doi:10.1007/s13762-013-0390-1.
- ↑ Joana M. Gomes, Simone S. Silva, Rui L. Reis: Biocompatible ionic liquids: fundamental behaviours and applications. In: Chemical Society Reviews. Band 48, Nr. 15, 2019, S. 4317–4335, doi:10.1039/C9CS00016J.
- ↑ Brezana Peric, Jordi Sierra, Esther Martí, Robert Cruañas, Maria Antonia Garau, Jürgen Arning, Ulrike Bottin-Weber, Stefan Stolte: (Eco)toxicity and biodegradability of selected protic and aprotic ionic liquids. In: Journal of Hazardous Materials. Band 261, 2013, S. 99–105, doi:10.1016/j.jhazmat.2013.06.070.
- ↑ Nadège Ferlin, Matthieu Courty, Sylvain Gatard, Marcel Spulak, Brid Quilty, Ian Beadham, Mukund Ghavre, Annette Haiß, Klaus Kümmerer, Nicholas Gathergood, Sandrine Bouquillon: Biomass derived ionic liquids: synthesis from natural organic acids, characterization, toxicity, biodegradation and use as solvents for catalytic hydrogenation processes. In: Tetrahedron. Band 69, Nr. 30, 2013, S. 6150–6161, doi:10.1016/j.tet.2013.05.054.
- ↑ Xue-Dan Hou, Qiu-Ping Liu, Thomas J. Smith, Ning Li, Min-Hua Zong: Evaluation of Toxicity and Biodegradability of Cholinium Amino Acids Ionic Liquids. In: PLOS ONE. Band 8, Nr. 3, 2013, S. e59145, doi:10.1371/journal.pone.0059145, PMID 23554985.