Stanum dioksida
| |

| |
| Nama | |
|---|---|
| Nama IUPAC
Tin (IV) Oxide
| |
| Nama lain | |
| Pengecam | |
| |
Imej model 3D Jmol
|
|
| ChemSpider | |
| ECHA InfoCard | 100.038.311 |
| Nombor EC |
|
PubChem CID
|
|
| Nombor RTECS |
|
CompTox Dashboard (EPA)
|
|
| |
| Sifat | |
| O2Sn | |
| Jisim molar | 150.71 g·mol−1 |
| Rupa bentuk | Serbuk kelabu putih atau putih[2] |
| Bau | Tidak berbau |
| Ketumpatan | 6.95 g/cm3 (20 °C)[3] 6.85 g/cm3 (24 °C)[4] |
| Takat lebur | 1,630 °C (2,970 °F; 1,900 K)[3][4] |
| Takat didih | 1,800–1,900 °C (3,270–3,450 °F; 2,070–2,170 K) Sublim[3] |
| Tidak boleh larut[4] | |
| Keterlarutan | Larut dalam alkali pekat panas,[4] asid pekat Tidak boleh larut dalam alkohol[3] |
| −4.1·10−5 cm3/mol[4] | |
Indeks biasan (nD)
|
2.006[5] |
| Struktur | |
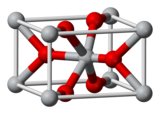
| Struktur kristal | Rutile tetragonal, tP6[6] |
| Kumpulan ruang | P42/mnm, No. 136[6] |
| 4/m 2/m 2/m[6] | |
| Pemalar kekisi | a = 4.737 Å, c = 3.185 Å[6] α = 90°, β = 90°, γ = 90°
|
| Geometri koordinasi |
Oktahedral (Sn4+) Trigonal planar (O2−) |
| Termokimia | |
| Muatan haba tentu, C | 52.6 J/mol·K[4] |
| Entropi molar piawai S |
49.04 J/mol·K[4][7] |
Entalpi pembentukan
piawai (ΔfH⦵298) |
−577.63 kJ/mol[4][7] |
Tenaga bebas Gibbs (ΔfG˚)
|
−515.8 kJ/mol[4] |
| Bahaya | |
| MSDS | ICSC 0954 |
| NFPA 704 (berlian api) | |
| Dos maut (LD) atau kepekatan dos maut (LC) | |
LD50 (median dos)
|
> 20 g/kg (rats, oral)[8] |
| NIOSH (Had pendedahan kesihatan AS): | |
PEL (Dibenarkan)
|
tiada[2] |
REL (Disyorkan)
|
TWA 2 mg/m3[2] |
IDLH (Bahaya serta-merta)
|
N.D.[2] |
| Sebatian berkaitan | |
| Timah(II) oksida | |
Kecuali jika dinyatakan sebaliknya, data diberikan untuk bahan-bahan dalam keadaan piawainya (pada 25 °C [77 °F], 100 kPa). | |
| | |
| Rujukan kotak info | |
Stanum dioksida (stanum(IV) oksida), juga dikenal sebagai timah dioksida, stannic oksida, adalah sebatian tak organik dengan formula SnO2. Bentuk mineral SnO2 dipanggil kasiterit, dan ini adalah bijih timah yang utama.[9] Dengan banyak nama-nama lain, timah oksida ini ialah bahan mentah yang paling penting dalam kimia timah. Ia merupakan pepejal tidak berwarna, diamagnetik, dan amfoterik.
Struktur
[sunting | sunting sumber]
No2 dalam betuk berair telah digambarkan sebagai asid stannik. Bahan-bahan tersebut muncul untuk menjadi zarah terhidrasi SnO2 di mana komposisi mencerminkan saiz zarah.[10]
Penyediaan
[sunting | sunting sumber]Timah(IV) oksida berlaku secara alami. Timah(IV) oksida sintetik dihasilkan dengan membakar logam timah dalam udara. Pengeluaran tahunannya dalam lingkungan 10 kilotan. SnO2 diturunkan secara industri kepada logam timah dengan karbon di relau gema pada 1200-1300 °C.[11]
Amfoterisme
[sunting | sunting sumber]Walaupun SnO2 larut dalam air, ia adalah amfoterik, larut dalam bes dan asid.[12] "Asid stannik" merujuk kepada timah (IV) oksida terhidrasi, SnO2, yang juga disebut "stannik hidroksida."
Timah oksida larut dalam asid. Asid halogen menyerang SnO2 untuk memberikan heksahalostannat,[13] seperti [SnI6]2−. Satu laporan menerangkan tindak balas sampel dalam refluks HI selama berjam-jam.[14]
- SnO2 + 6 HI → H2SnI6 + 2 H2O
Begitu juga, SnO2 larut dalam asid sulfurik untuk memberi sulfat:
Rujukan
[sunting | sunting sumber]- ^ Ralat petik: Tag
<ref>tidak sah; tiada teks disediakan bagi rujukan yang bernamamfa - ^ a b c d NIOSH Pocket Guide to Chemical Hazards. "#0616" (dalam bahasa Inggeris). National Institute for Occupational Safety and Health (NIOSH).
- ^ a b c d CID 29011 daripada PubChem
- ^ a b c d e f g h i Templat:CRC90
- ^ Pradyot, Patnaik (2003). Handbook of Inorganic Chemicals. The McGraw-Hill Companies, Inc. m/s. 940. ISBN 0-07-049439-8.
- ^ a b c d Baur, W.H. (1956). "Über die Verfeinerung der Kristallstrukturbestimmung einiger Vertreter des Rutiltyps: TiO2, SnO2, GeO2 und MgF2". Acta Crystallographica. 9 (6): 515–520. doi:10.1107/S0365110X56001388.
- ^ a b Stannic oxide dalam Linstrom, Peter J.; Mallard, William G. (penyunting); NIST Chemistry WebBook, NIST Standard Reference Database Number 69, National Institute of Standards and Technology, Gaithersburg (MD) (dicapai pada 2014-07-04)
- ^ a b "MSDS of Tin(IV) oxide". https://www.fishersci.ca. Fisher Scientific. Dicapai pada 2014-07-04. External link in
|website=(bantuan) - ^ Templat:Greenwood&Earnshaw1st
- ^ Templat:Holleman&Wiberg
- ^ Tin: Inorganic chemistry,J L Wardell, Encyclopedia of Inorganic Chemistry ed R. Bruce King, John Wiley & Son Ltd., (1995) ISBN 0-471-93620-0
- ^ Inorganic & Theoretical chemistry, F. Sherwood Taylor, Heineman, 6th Edition (1942)
- ^ Donaldson & Grimes in Chemistry of tin ed.
- ^ Earle R. Caley (1932). "The Action Of Hydriodic Acid On Stannic Oxide". J. Am. Chem. Soc. 54 (8): 3240–3243. doi:10.1021/ja01347a028.
Terus membaca
[sunting | sunting sumber]- "How Pilkington Energy Advantage™ Low-E Glass Works" (PDF). Pilkington Group Limited. 18 July 2005. Dicapai pada 2012-12-02.[pautan mati kekal] Teknikal perbincangan bagaimana No2:F digunakan dalam keberpancaran rendah (rendah-E). Laporan itu termasuk pantulan dan pemindahan spectra.
- "NIOSH Pocket Guide to Chemical Hazards - Tin(IV) oxide (as Sn)". Centers for Disease Control and Prevention. 4 April 2011. Dicapai pada 2013-11-05. Maklumat mengenai keselamatan bahan kimia dan had pendedahan

