8-hidroxiquinoleína
| 8-hidroxiquinoleína | ||
|---|---|---|
 | ||
 | ||
| General | ||
| Fórmula molecular | C9H7NO | |
| Identificadores | ||
| Número CAS | 148-24-3[1] | |
| ChEMBL | CHEMBL310555 | |
| KEGG | C19434 D05321, C19434 | |
| Propiedades físicas | ||
| Apariencia | agujas cristalinas blanquecinas | |
| Densidad | 1034 kg/m³; 1,034 g/cm³ | |
| Masa molar | 145,16 g/mol | |
| Punto de fusión | 76 °C (349 K) | |
| Punto de ebullición | 276 °C (549 K) | |
| Peligrosidad | ||
| Frases R | R22 | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
La 8-hidroxiquinoleína (también conocida como oxina) es un compuesto orgánico de fórmula C9H7NO. Es un derivado heterociclo de la quinoleína con un sustituyente hidroxil (-OH) en el carbono 8. Este compuesto, es ampliamente utilizado comercialmente bajo una gran variedad de nombres.[2][3] En el análisis químico cuantitativo tiene interés como reactivo quelante, ya que forma complejos coloreados y luminiscentes con numerosos iones metálicos, lo que permite la determinación de estos mediante procedimientos espectrofotométricos y espectrofluorimétricos. En disolución acuosa se comporta como un ácido débil (pKa = 9,9).
Síntesis
[editar]Por lo general, se prepara a partir de la quinoleína, mediante sulfonación a 220ºC. El ácido quinolein-8-sulfónico es posteriormente sometido a fusión alcalina, obteniéndose 8-hidroxiquinoleína.
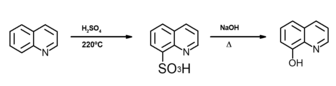
También se puede obtener mediante una síntesis de Skraup de 2-aminofenol.[4]
Agente quelante
[editar]La 8-hidroxiquinoleína es un agente quelante monoprótico bidentado. Relacionada con las bases de Schiff derivados del salicilaldehído, tales como salicilaldoxima y salen. En solución neutra, el hidroxilo está en forma protonada (pKa = 9,89) y el nitrógeno está no protonado (pKa = 5,13).[5] Sin embargo, existe un estado excitado isómero de ion híbrido, zwitterión, en el que un H+ se transfiere desde el oxígeno ( dando un anión oxígeno ) al nitrógeno (dando un catión nitrógeno protonado ).[6]
Numerosos cationes, especialmente los de metales de transición forman quelatos poco solubles con 8-hidroxiquinoleína (oxina), que a veces reciben el nombre de oxinatos. La solubilidad de estos quelatos varía ampliamente dependiendo del catión que forma el complejo, dependiendo también del pH del medio, ya que la reacción de quelación implica la eliminación de protones. De este modo, controlando el pH se consigue cierto grado de selectividad.[7] Estos oxinatos poco solubles pueden ser utilizados para el análisis gravimétrico de los metales con los que precipita. Igualmente, dado que los oxinatos presentan absorción de la radiación ultravioleta-visible e incluso emisión fluorescente, la 8-hidroxiquinoleina tambien tiene gran aplicación en la determinación de iones metálicos mediante procedimientos espectrofotométricos y espectrofluorimétricos. Dada la poca solubilidad de los oxinatos, estos procedimientos requieren la extracción previa en un disolvente adecuado.[8]
Aplicaciones
[editar]
Los complejos de 8-Hq, así como el propio heterociclo, pueden ser utilizados como antisépticos, desinfectantes, habiendo sido utilizados como medicamentos para el tratamiento del cáncer. Asimismo, poseen acción pesticida.[9][10] La 8-Hq actúa como inhibidor de la transcripción, presumiblemente por intercalación entre pares de bases en la hebra de DNA, dificultando la acción de enzimas topoisomerasas.[11] Su solución en alcohol se utiliza como "venda líquida".[12]
La reacción de 8-hidroxiquinolina con aluminio (III)[13] da lugar a la formación del compuesto Tris(8-hydroxoquinolinato)aluminio , un componente común de los diodos orgánicos emisores de luz (OLED). Las variaciones de los sustituyentes en los anillos de quinoleína da lugar a diferentes propiedades de luminiscencia.[14]
Las raíces de la planta Centaurea diffusa liberan 8-hidroxiquinolina, que tiene un efecto negativo sobre otras plantas.
La hidroxiquinolina se usó como un estabilizador del peróxido de hidrógeno en el comburente para cohetes (T-Stoff) para el motor Walter HWK 109-509 en la Segunda Guerra Mundial.
Referencias
[editar]- ↑ Número CAS
- ↑ «8-Hydroxyquinoline Safety Data». Oxford University. (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).
- ↑ «8-Hydroxyquinoline». PAN Pesticides Database.
- ↑ Collin, G.; Höke, H. (2005). «Quinoline and Isoquinoline». Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a22_465.
- ↑ Albert, A.; Phillips, J. N. (1956). "264. Ionization Constants of Heterocyclic Substances. Part II. Hydroxy-Derivatives of Nitrogenous Six-Membered Ring-Compounds". Journal of the Chemical Society (Resumed) 1956: 1294–1304. doi:10.1039/JR9560001294.
- ↑ Bardez, E.; Devol, I.; Larrey, B.; Valeur, B. (1997). "Excited-State Processes in 8-Hydroxyquinoline: Photoinduced Tautomerization and Solvation Effects". The Journal of Physical Chemistry B 101 (39): 7786–7793. doi:10.1021/jp971293u.
- ↑ Douglas A. Skoog, Donald M. West, F. James Holler and Stanley R. Crouch. (2015). «Cap.12C.3 Agentes precipitantes orgánicos». Fundamentos de química analítica. Cengage Learning. ISBN 978-607-519-937-6.
- ↑ Kolthoff, I.M.; Sandell, E.B. y otros (1976). Análisis Químico Cuantitativo. Logroño: Nigar. pp. 373-377. ISBN 84-7359-042-2.
- ↑ Phillips, J. P. (1956). «The Reactions of 8-Quinolinol». Chemical Reviews 56 (2): 271-297. doi:10.1021/cr50008a003.
- ↑ «8-Hydroxyquinoline». Medical Dictionary Online. Archivado desde el original el 18 de junio de 2010.
- ↑ «8-Hydroxyquinoline». Sigma-Aldrich. Consultado el 23 de mayo de 2012.
- ↑ Shen, A. Y.; Wu, S. N.; Chiu, C. T. (1999). «Synthesis and Cytotoxicity Evaluation of some 8-Hydroxyquinoline Derivatives». Journal of Pharmacy and Pharmacology 51 (5): 543-548. PMID 10411213. doi:10.1211/0022357991772826.
- ↑ Katakura, R.; Koide, Y. (2006). «Configuration-Specific Synthesis of the Facial and Meridional Isomers of Tris(8-hydroxyquinolinate)aluminum (Alq3)». Inorganic Chemistry 45 (15): 5730-5732. doi:10.1021/ic060594s.
- ↑ Montes, V. A.; Pohl, R.; Shinar, J.; Anzenbacher, P. Jr. (2006). «Effective Manipulation of the Electronic Effects and Its Influence on the Emission of 5-Substituted Tris(8-quinolinolate) Aluminum(III) Complexes». Chemistry - A European Journal 12 (17): 4523-4535. doi:10.1002/chem.200501403.
