細胞骨格
| 細胞生物学 | |
|---|---|
| 動物細胞の模式図 | |
 |

細胞骨格(さいぼうこっかく、英語: cytoskeleton, CSK)は、細胞質内に存在し、細胞の形態を維持し、また細胞内外の運動に必要な物理的力を発生させる細胞内の繊維状構造。細胞内での各種膜系の変形・移動と細胞小器官の配置、また、細胞分裂、筋収縮、繊毛運動などの際に起こる細胞自身の変形を行う重要な細胞小器官。
細胞骨格はすべての細胞に存在する。かつては真核生物に特有の構造だと考えられていたが、最近の研究により原核生物の細胞骨格の存在が確かめられた。
細胞骨格という概念と用語(フランス語で cytosquelette)は、1931年、フランスの発生生物学者 Paul Wintrebert によって導入された[1]。
真核生物の細胞骨格
[編集]
真核生物の細胞には、電子顕微鏡で観察することができる、主に3種類の細胞骨格がある。アクチンフィラメント、中間径フィラメント、微小管である。細胞骨格は細胞に構造と形態を与える。また、細胞質基質中の高分子に排除体積効果を与えることで、分子クラウディング効果のレベルを増加させる[2]。
アクチンフィラメント
[編集]マイクロフィラメントの直径は5〜9nm。2つのアクチン鎖が縒り合わさって構成されている。マイクロフィラメントのほとんどは細胞膜の直下に集中しており、張力に抵抗する、細胞の形を保つ、細胞質突起を形成する(仮足や微絨毛など。ただしこれらの機構はそれぞれ異なる)、細胞間や細胞-基質間の接合に関わる、などの役割を果たしている。後者の機能に関しては、マイクロフィラメントはシグナル伝達に必須である。これらは細胞質分裂にも重要(特に分裂溝生成時に)な役割を果たし、またミオシンと協同して横紋筋を作る。アクチン/ミオシン共同体は、ほとんどの細胞で細胞質流動を作り出す。
中間径フィラメント
[編集]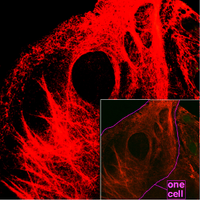
中間フィラメントあるいは10 nmフィラメントとも呼ばれる。
これらのフィラメントは直径8〜12nm、アクチンフィラメントよりも丈夫な、細胞質中の複数種の構成要素である。アクチンフィラメントと同様に、張力に抵抗することによって細胞の形態を保つ働きがある(微小管はこれと対照的に、圧力に抵抗する。マイクロフィラメントと中間径フィラメントは鉄筋に当たり、微小管は鉄骨に当たると考えるとよい)。中間径フィラメントは、細胞内部の3次元構造を構成し、オルガネラを固定し、核ラミナやサルコメアの要素となる。また細胞間や細胞-基質間接合にも関わる。
中間径フィラメントには、以下のようなものがある。
- ビメンチンからなるもの。多くの細胞で共通に見られる。
- ケラチンからなるもの。内胚葉及び外胚葉のあらゆる上皮細胞。陸上脊椎動物の皮膚細胞、髪や爪の細胞では角質化を担う。
- ニューロフィラメント。神経細胞に存在する。
- ラミンからなるもの。核膜をかたちづくる。
微小管
[編集]
微小管は、中空な管状で、直径は約25nm(内径は約15nm)、ほとんどの場合の共通構造としては、αおよびβチューブリンが互い違いに結合したプロトフィラメント13本からできている。これはグアノシン三リン酸の重合によって非常に動的なふるまいをする。中心体によって統合される。
3つ組み9本(星形)のセットで中心小体を形成し、2つ組み9本と中央の2本の微小管(車輪型)のセットで繊毛や鞭毛を形成する。後者の形態はよく「9+2」と言われる。ここではそれぞれの2つ組みは、ダイニンタンパク質によって連結される。鞭毛と繊毛は細胞の構造体であり、微小管から構成されるので、これらは細胞骨格の一部だと考えることもできる。
これは以下の現象に重要な働きをなしている:
比較
[編集]| 細胞骨格の種類 | 直径 (nm) [3] | 構造 | サブユニットの例[3] |
|---|---|---|---|
| マイクロフィラメント | 5-9 | 二重らせん | アクチン |
| 中間径フィラメント群 | 8-12 | two parallel helices[要曖昧さ回避]/dimers, forming tetramers |
|
| 微小管 | 25 | 微小管プロトフィラメント, in turn consisting of tubulin subunits | α、βチューブリン |
Microtrabeculae(別の網状構造?)
[編集]1970年代、Keith Porter は 、細胞の高圧電子顕微鏡画像を基に、真核生物の4つめの細胞骨格の要素 microtrabeculae を提唱した[4]。画像には、短い繊維状で、不明なタンパク質からなり、他の細胞質構造と結びついている構造が映し出されていた。Porter はこの微小柱状の構造を、微小管、中間径フィラメント、アクチンフィラメントのどれとも異なる新種の繊維網状構造と提唱した。しかしながら、細胞骨格についてすべてがわかっているわけではないが、 microtrabeculae は現在一般的には、細胞固定処理の影響で作られた構造にすぎないと考えられている[5]。
原核生物の細胞骨格
[編集]細胞骨格は以前は真核生物細胞のみにある構造だと考えられていた。しかし近年、細胞骨格の主要なタンパク質と相同なものが原核生物中にも発見された[6]。進化的な関係が遠いので、タンパク質のアミノ酸配列のみの比較だけでは明白ではないのだが、タンパク質の立体構造の類似性と、細胞の形態と極性を維持するという機能の類似が、真核生物と原核生物の細胞骨格が真に相同であるという強い証拠を与えている[7]。しかし、細菌の細胞骨格については、まだいくつかの明らかにすべき点が残っている[8]。
FtsZ
[編集]FtsZは最初に同定された原核生物の細胞骨格タンパク質である。チューブリンに似て、FtsZはグアノシン3リン酸の存在下で繊維構造を作る。細胞分裂中にFtsZは最初に分裂位置に来るタンパク質であり、新たな細胞壁を構成するための他のタンパク質を補充するのに必須である。クレン古細菌及びタウム古細菌を除くほぼすべての原核生物、ミトコンドリアや葉緑体の分裂にも使用される。
アクチン様タンパク
[編集]真正細菌のMreBは、細胞の形を保つ働きをする。球状以外の全ての細菌は、アクチンに似たタンパク質に翻訳される遺伝子を持つ。これらのタンパク質は細胞膜の直下でらせん状の構造をとり、細胞壁の生合成をなすタンパク質を導く役目を持つ。
いくつかのプラスミドからエンコードされる分裂系は、アクチン類似のタンパク質ParMを含んでいる。ParMの繊維は動的不安定性を示す。そしてプラスミドのDNAを、分裂後の娘細胞へ分ける。その機構は真核生物の体細胞分裂で働く微小管と相似である。
この他、磁性細菌が持つMamKなどが知られる。
クレン古細菌のテルモプロテウス目が持つアクチン様タンパクはアクチンの祖先型とみなされており、クレンアクチンと呼ばれている。機能はMreBと同様である。
クレセンチン
[編集]バクテリアの Caulobacter crescentus は、第3のタンパク質クレセンチン(crescentin)を含んでいる。これは真核生物の中間径フィラメントと関係している。クレセンチンは、らせん状やビブリオ様の細菌の形態を保つ役割もしている。しかしその機序は現在明らかにはされていない[9]。
脚注
[編集]- ^ Frixione E (June 2000). “Recurring views on the structure and function of the cytoskeleton: a 300-year epic”. Cell motility and the cytoskeleton 46 (2): 73–94. doi:10.1002/1097-0169(200006)46:2<73::AID-CM1>3.0.CO;2-0. PMID 10891854.
- ^ Minton AP (October 1992). “Confinement as a determinant of macromolecular structure and reactivity”. Biophys. J. 63 (4): 1090–100. PMC 1262248. PMID 1420928.
- ^ a b Unless else specified in boxes, then ref is:Walter F., PhD. Boron (2003). Medical Physiology: A Cellular And Molecular Approaoch. Elsevier/Saunders. pp. 1300. ISBN 1-4160-2328-3 Page 25
- ^ Wolosewick JJ, Porter KR (July 1979). “Microtrabecular lattice of the cytoplasmic ground substance. Artifact or reality”. J. Cell Biol. 82 (1): 114–39. PMC 2110423. PMID 479294.
- ^ Heuser J (2002). “Whatever happened to the 'microtrabecular concept'?”. Biol Cell 94 (9): 561–96. doi:10.1016/S0248-4900(02)00013-8.
- ^ Shih YL, Rothfield L (2006). “The bacterial cytoskeleton”. Microbiol. Mol. Biol. Rev. 70 (3): 729–54. doi:10.1128/MMBR.00017-06. PMID 16959967.
- ^ Michie KA, Löwe J (2006). “Dynamic filaments of the bacterial cytoskeleton”. Annu. Rev. Biochem. 75: 467–92. doi:10.1146/annurev.biochem.75.103004.142452. PMID 16756499.
- ^ Briegel A, Dias DP, Li Z, Jensen RB, Frangakis AS, Jensen GJ (October 2006). “Multiple large filament bundles observed in Caulobacter crescentus by electron cryotomography”. Mol. Microbiol. 62 (1): 5–14. doi:10.1111/j.1365-2958.2006.05355.x. PMID 16987173.
- ^ Ausmees N, Kuhn JR, Jacobs-Wagner C (December 2003). “The bacterial cytoskeleton: an intermediate filament-like function in cell shape”. Cell 115 (6): 705–13. PMID 14675535.
参考文献
[編集]- Linda A. Amos and W. Gradshaw Amos, Molecules of the Cytoskeleton, Guilford, ISBN 0-89862-404-5, LoC QP552.C96A46 1991
外部リンク
[編集]- 細胞骨格 - 脳科学辞典
- Cytoskeleton, Cell Motility and Motors - The Virtual Library of Biochemistry and Cell Biology
- Cytoskeleton database, clinical trials, recent literature, lab registry ...
- Animation of leukocyte adhesion (Animation with some images of actin and microtubule assembly and dynamics.)
