Natriumbikarbonaat
|
Algemeen | |
|---|---|
| Naam | Natriumbikarbonaat |
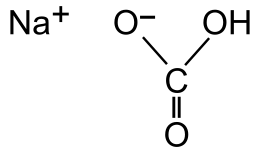 | |
| Chemiese formule | NaHCO3 |
| Molêre massa | 84.01 g/mol |
| CAS-nommer | 144-55-8 |
| Voorkoms | wit, kristallyn |
| Fasegedrag | |
| Selkonstantes | a=352pm; b=970pm; c=807pm; β=112° |
| Ruimtegroep | P21/c |
| Nommer | 14 |
| Schönfliess-simbool | C52h |
| Strukturbericht | G0₁₂ |
| Smeltpunt | 300 °C (573.15 K) |
| Kookpunt | |
| Digtheid | 2.16 g/cm3 |
| Oplosbaarheid | 100 |
|
Suur-basis eienskappe | |
| pKa | |
|
Veiligheid | |
| Flitspunt | |
|
Tensy anders vermeld is alle data vir standaardtemperatuur en -druk toestande. | |
| Portaal | |
Natriumbikarbonaat (Natriumwaterstofkarbonaat, koeksoda) is 'n wit kristallyne stof wat dikwels as rysmiddel en bestanddeel in bakpoeier gebruik word. Dit is die waterstofkarbonaat-Sout (chemiese stof) van natrium. Dit kom in die natuur as die mineraal nahcoliet voor.[1]
Kristalstruktuur
[wysig | wysig bron]
Natriumbikarbonaat kristalliseer in 'n monokliniese struktuur, wat die argetipe van die G012-struktuur van die strukturbericht-klassifikasie is.[2] Die struktuur bevat anioonlae wat ongeveer aan die 102-lae ewewydig is. Elke natiumioon is deur 'n effens verwronge oktaëder van suurstofatome omring. Die Na-O-afstande wissel van 238,9pm tot 247,2pm. Die anioonlae bestaan uit oneindige kettings van bikarbonaatione wat deur waterstofbinding bymekaar gehou word in 'n effens geplooide ketting.[3]
Gebruike
[wysig | wysig bron]As toevoeging tot kossoorte het dit die E-nommer E 500. Dit word ook gebruik as ligte skoonmaak- of skuurmiddel vir huishoudelike gebruik, en as bestanddeel van maagtablette teen sooibrand. Wanneer dit met 'n sterk of swak suur gemeng word, ontbind dit en stel koolstofdioksied gas vry.
Vroeër was Natriumbikarbonaat gebruik om die borrels in sodawater te maak, en dit word steeds as bestanddeel in baie Asiatiese geregte gebruik.
Natriumbikarbonaat word in die menslike liggaam in groot hoeveelhede deur die pankreas vervaardig om maagsuur in die dunderm te neutraliseer met die volgende reaksie:
Met 'n basis reageer dit soos volg:
Verwysings
[wysig | wysig bron]- ↑ "Nahcolite". Mindat 2831.
- ↑ "Nahcolite". Aflow.
- ↑ Sass, R.L. and Scheuerman, R.F. (1962). "The crystal structure of sodium bicarbonate". Acta Cryst. 15: 77–81. doi:10.1107/S0365110X62000158.
{{cite journal}}: AS1-onderhoud: gebruik authors-parameter (link)
