بيرول
المظهر
| بيرول | |
|---|---|
 |
 |
 |
 |
| التسمية المفضلة للاتحاد الدولي للكيمياء البحتة والتطبيقية | |
1H-Pyrrole |
|
| أسماء أخرى | |
Azole |
|
| المعرفات | |
| رقم CAS | 109-97-7 |
| بوب كيم | 8027 |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
| الخواص | |
| الصيغة الجزيئية | C4H5N |
| الكتلة المولية | 67.09 غ/مول |
| المظهر | سائل عديم اللون |
| الكثافة | 0.97 غ/سم3 |
| نقطة الانصهار | − 24 °س |
| نقطة الغليان | 131 °س |
| الذوبانية في الماء | 60 غ/ل ماء |
| الذوبانية | ينحل في أغلب المذيبات العضوية |
| حموضة (pKa) | -3.8 [3] |
| المخاطر | |
| ترميز المخاطر | |
| توصيف المخاطر | |
| تحذيرات وقائية | |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
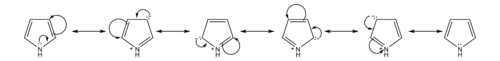
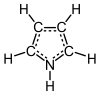
البيرول مركب عضوي له الصيغة C4H5N ، وهو من المركبات العطرية الحلقية غير المتجانسة. بنيته تتكون من حلقة خماسية غير مشبعة حاوية على ذرة نيتروجين.
الخصائص
[عدل]- البيرول سائل عديم اللون له رائحة تشبه رائحة الكلوروفورم. لدى تعرضه للهواء يتلون بلون بني ويتصمغ.
- قاعدية البيرول ضعيفة جداً بالمقارنة مع الأمينات والمركبات العطرية الأخرى مثل البيريدين (pKb له 13.6). يعود ذلك إلى مشاركة الزوج الإلكتروني الحر في تشكيل النظام العطري (ستة إلكترونات من النمط π ) حسب قاعدة هوكل، بالتالي فإن برتنة ذرة النيتروجين ستؤدي إلى فقدان هذه الخاصية العطرية.
بالمقابل يمكن أن تحدث عملية نزع بروتون من ذرة النيتروجين دون فقدان خاصية العطرية، وذلك بمفاعلة البيرول مع فلز البوتاسيوم حيث يتشكل بيرول البوتاسيوم وينطلق غاز الهيدروجين.
التحضير
[عدل]يحضر البيرول صناعياً من تفاعل الفوران مع الأمونياك. كما يحضر من تفاعل بوتين 4،1-ديول بالتسخين مع الأمونياك تحت الضغط.
مخبرياً يمكن تحضير البيرول ومشتقاته بعدة طرق منها:
كما يحضر بالطرق التالية:
- إمرار خليط من الفوران والأمونيا على الألومينا الساخنة كعامل مساعد.
- إمرار خليط من الأمونيا والأستيلين في أنبوب ذي درجة حرارة عالية.
- تسخين ثنائي الأستيلين مع الأمونيا أو أحد مشتقاتها عند درجة حرارة 140-160 س وفي وجود كلوريد النحاسوز يعطي البيرول أو أحد مشتقاته
- تسخين مركب سس-2-بيوتين-4,1-ثنائي أول مع الأمينات الأولية في وجود عامل مساعد مثل البلاديوم Pd يعطي ناتجاً ممتازاً من البيرول.
- تقطير السكسينيميد مع مسحوق الزنك.
- تسخين 4,1-ثنائي مجموعة الكربونيل مثل سكسينالدهيد مع كربونات الأمونيوم
- تقطير خليط من ميوكات الأمونيوم مع الجلسرين عند درجة حرارة 200-220o س حيث يتكون البيرول بالإضافة إلى ثاني أكسيد الكربون والماء والأمونيا, وهذه طريقة جيدة لتحضير البيرول لسهولة فصله من النواتج الجانبية الأخرى.
الأهمية
[عدل]يعد مركب البيرول المركب الأساسي الذي تشتق منه باقي مركبات الآزولات مثل مركبات البورفيرين التي شمل مثلاً البورفين والهيم واليخضور والكوبالامين بالإضافة إلى الأصبغة الصفراوية مثل بيليروبين ويوروبيلين.
مركبات مشابهة
[عدل]المراجع
[عدل]- ^ ا ب ج PYRROLE (بالإنجليزية), QID:Q278487
- ^ ChEBI release 2020-09-01، 1 سبتمبر 2020، QID:Q98915402
- ^ William Mickey Haynes, ed. (24 Jun 2016). CRC Handbook of Chemistry and Physics (بالإنجليزية) (97th ed.). Boca Raton. pp. 5–96. ISBN:978-1-4987-5428-6. OL:28039375M. QID:Q42107747.
{{استشهاد بكتاب}}: صيانة الاستشهاد: مكان بدون ناشر (link)
| بيرول في المشاريع الشقيقة: | |
| |