حديدات رباعي كربونيل ثنائي الصوديوم
المظهر
| حديدات رباعي كربونيل ثنائي الصوديوم | |
|---|---|
| الاسم النظامي (IUPAC) | |
disodium tetracarbonylferrate |
|
| تسمية الاتحاد الدولي للكيمياء | |
disodium tetracarbonylferrate |
|
| أسماء أخرى | |
disodium iron tetracarbonyl, Collman's reagent |
|
| المعرفات | |
| CAS | 14878-31-0 |
| الخواص | |
| الصيغة الجزيئية | C4FeNa2O4 |
| الكتلة المولية | 213.87 غ/مول |
| المظهر | صلب عديم اللون |
| الكثافة | 2.16 غ/سم3 |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
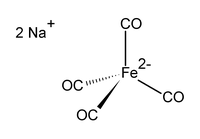
حديدات رباعي كربونيل ثنائي الصوديوم هو مركب كيميائي صيغته Na2[Fe(CO)4]، ويوجد ضمن شروط معينة على هيئة صلب عديم اللون. يدعى هذا المركب أيضاً باسم كاشف كولمان.
التحضير
[عدل]يحضّر هذا المركب من اختزال خماسي كربونيل الحديد باستخدام فلز الصوديوم:[1]
يمكن بشكل آخر إجراء الاختزال باستخدام ملغمة الصوديوم في وسط من رباعي هيدرو الفوران.[2]
الخواص
[عدل]تتكون بنية حديدات رباعي كربونيل ثنائي الصوديوم من ذرة حديد مركزية مرتبطة مع ربيطات من الكربونيل، وتعادل الشحنة بوجود أيونات الصوديوم؛ بحيث أن الحديد يكون في حالة الأكسدة النادرة -2. من حيث البنية فإن هذا المركب متساوٍ إلكترونياً مع رباعي كربونيل النيكل.[3][4]
الاستخدامات
[عدل]يستخدم هذا المركب في اصطناع الألدهيدات من هاليدات الألكيل.[5]
طالع أيضاً
[عدل]المراجع
[عدل]- ^ H. Behrens, R. Weber: Zur Kenntnis der Chemie der Metallcarbonyle in flüssigem Ammoniak. I. Über die Reaktionen der Carbonyle des Eisens und Kobalts mit Alkalimetallen. In: Zeitschrift für anorganische und allgemeine Chemie. 281, 1955, S. 190–198, دُوِي:10.1002/zaac.19552810309.
- ^ Manning P. Cooke: Facile conversion of alkyl bromides into aldehydes using sodium tetracarbonylferrate(-II). In: Journal of the American Chemical Society. 92, 1970, S. 6080–6082, دُوِي:10.1021/ja00723a056.
- ^ Chin, H. B.؛ Bau, R. (1976). "The Crystal Structure of Disodium Tetracarbonylferrate. Distortion of the Tetracarbonylferrate2− Anion in the Solid State". Journal of the American Chemical Society. ج. 98 ع. 9: 2434–2439. DOI:10.1021/ja00425a009.
- ^ Teller, R. G.; Finke, R. G.; Collman, J. P.; Chin, H. B.; Bau, R. (1977). "Dependence of the tetracarbonylferrate(2-) geometry on counterion: crystal structures of dipotassium tetracarbonylferrate and bis(sodium crypt) tetracarbonylferrate [crypt = N(CH2CH2OCH2CH2OCH2CH2)3N]". Journal of the American Chemical Society. ج. 99 ع. 4: 1104–1111. DOI:10.1021/ja00446a022.
- ^ Pike, R. D. (2001). "Disodium Tetracarbonylferrate(-II)". Encyclopedia of Reagents for Organic Synthesis. DOI:10.1002/047084289X.rd465.

![{\displaystyle \mathrm {[Fe(CO)_{5}]+2\ Na\rightarrow \ Na_{2}[Fe(CO)_{4}]+CO} }](http://178.128.105.246/cars-https-wikimedia.org/api/rest_v1/media/math/render/svg/f14a510e38feb52afc02083e7745e9805b498b2f)