Triosa fosfat isomerasa
 Representació del monòmer de triosa fosfat isomerasa. El centre actiu està al centre del barril alfa-beta | |
| Substància | família d'enzims |
|---|---|
| Nombre EC | 5.3.1.1 |
| Locus | Cr. 12 p13 |
| Identificadors | |
| Símbol | TPI |
| HUGO | 12009 |
| Entrez | 7167 |
| RefSeq | NM_000365 |
La triosa fosfat isomerasa (TPI) és un enzim que catalitza la interconversió entre dihidroxiacetona fosfat (DHAP) i D-gliceraldehid-3-fosfat (GAPD) en la glucòlisi. La triosa fosfat isomerasa és un enzim molt eficient, ja que la reacció té lloc bilions de vegades més ràpid amb catàlisi que espontàniament. La reacció és tan eficient que es diu que és catalíticament perfecte: només està limitada per la quantitat de substrat disponible. La triosa fosfat isomerasa s'ha aïllat en quasi tots els organismes on s'ha buscat, incloent-hi animals, com mamífers i insectes, així com fongs, plantes i bacteris. Tot i així, alguns bacteris que no realitzen la glucòlisi, com els ureaplasmes, no en presenten. En els humans, el dèficit de triosa fosfat isomerasa, autosòmic recessiu, està associat a un greu trastorn neurològic progressiu i a una anèmia hemolítica constant.
Reacció catalitzada
[modifica]
La triosa fosfat isomerasa catalitza la isomerització de dihidroxiacetona fosfat (DHAP) en D-gliceraldehíd-3-fosfat (GAPD).

Estructura
[modifica]La triosa fosfat isomerasa és un homodímer en el que cada subunitat conté uns 250 residus d'aminoàcids. L'estructura tridimensional presenta vuit fulls beta paral·lels a l'interior i vuit hèlix alfa, a l'exterior. Aquest motiu estructural rep el nom de barril alfa-beta (barril-αβ). El seu centre actiu es troba en el centre d'aquest barril i conté un residu d'àcid glutàmic (Glu 165) i un altre d'histidina (His 95), essencials per la catàlisi. La seqüència dels aminoàcids del centre actiu es conserva en totes les trioses fosfat isomerases que es coneixen.
A pH fisiològic, el glutamat està desprotonat i, per tant, carregat negativament, el que provoca l'atracció del protó del carboni 2 del GADP. La histidina, bàsica, actua com un grup donador de protons per transferir-los entre el grup carbonil i el grup hidroxil del carboni 2 del substrat.
Mecanisme
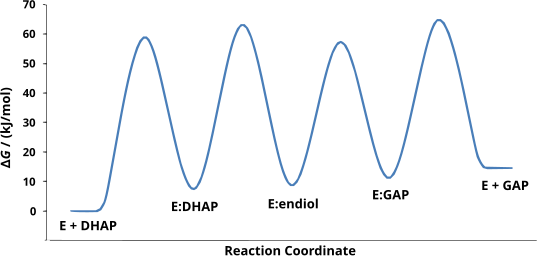
[modifica]El mecanisme fa intervenir la formació intermediària d'enediol. Els canvis d'energia lliure s'han calculat per a cada etapa de la reacció, incloent-hi els estats de transició. Es mostren en la següent figura.[1]
Bibliografia
[modifica]- Mathews, C. K.; Van Holde, K.E et Ahern, K.G (2003). Bioquímica (3 edició). ISBN 84-7829-053-2.
Referències
[modifica]- ↑ Albery, W. J.; Knowles, J. R. «Free-Energy Profile for the Reaction Catalyzed by Triosephosphate Isomerase». Biochemistry, 15, 25, 1976, pàg. 5627–5631. DOI: 10.1021/bi00670a031. PMID: 999838.
Enllaços externs
[modifica]- Triosephoshate Isomerase a Proteopedia.org (anglès)
- Triosephosphate isomerase (TIM) family a PROSITE (anglès)
- Triosephosphate isomerase a NCBI

