Ullmannova kondenzace
Ullmannova kondenzace nebo reakce Ullmannova typu je reakce, při níž dochází k přeměně arylhalogenidů na odpovídající ethery, thioethery, nitrily a aminy.[1] Ullmannovy kondenzace jsou podobné Buchwaldovým–Hartwigovým aminacím, ovšem obvykle se musejí provádět při vyšších teplotách. Používají se při nich polární rozpouštědla s vysokou teplotou varu, jako jsou N-methylpyrrolidon, nitrobenzen a dimethylformamid, a probíhají při vysokých teplotách (často přesahujících 210 °C) za přítomnosti stechiometrických množství mědi. Arylhalogenidy při nich musí být aktivovány skupinami odtahujícími elektrony. Při původních Ulmannových reakcích se používala prášková měď připravovaná redukcí síranu měďnatého kovovým zinkem v horké vodě. Tento postup byl vylepšen pomocí rozpustných katalyzátorů obsahujících diaminové a acetylacetonátové ligandy.[1]
Syntéza etherů (tvorba vazeb C-O)
[editovat | editovat zdroj]Ukázkovým příkladem přípravy etherů pomocí Ullmannovy kondenzace je příprava p-nitrofenylfenyletheru z 4-chlornitrobenzenu a fenolu.[2]
- O2NC6H4Cl + HOC6H5 + KOH → O2NC6H4OC6H5 + KCl + H2O
V současnosti se tyto reakce provádějí za přítomnosti rozpustných katalyzátorů.[3]
Goldbergové reakce (tvorba vazby C-N)
[editovat | editovat zdroj]Jako příklad Goldbergové reakce lze uvést přípravu kyseliny fenamové, meziproduktu při výrobě akridonu:[4]
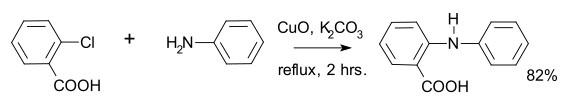
Jako arylační činidla se zde nejčastěji používají aryljodidy.[5] Použitý katalyzátor byl vytvořen z jodidu měďného a fenantrolinu. Reakce nejlépe probíhá při použití aryljodidů s vysokou elektronovou hustotou a je tak alternativou k Buchwaldově-Hartwigově aminaci, která nejlépe probíhá u arylhalogenidů s nízkou elektronovou hustotou. Reakci lze provést i s amidy.[1]

Hurtleyova reakce (tvorba vazeb C-C)
[editovat | editovat zdroj]K tvorbě vazeb C-C pomocí Ullmannovy kondenzace je možné jako nukleofily použít karboanionty i nitrily. V původní reakci byly tyto nukleofily odvozeny od esterů kyseliny malonové a od dalších dikarbonylových sloučenin:[7]
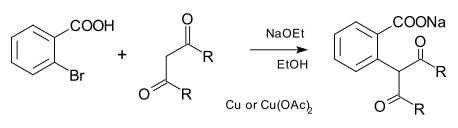
U současných reakcí vytvářejících vazby C-C se používá katalýza komplexy mědi s fenantrolinem.[8]
Tvorba vazeb C-S
[editovat | editovat zdroj]Arylace alkylthiolátů se provádí za přítomnosti měďných thiolátů.[9]
Mechanismus
[editovat | editovat zdroj]Reaktanty používané při reakcích Ullmannova typu (alkoxidy, amidy nebo thioláty, zpravidla měďné, ale někdy i měďnaté) se obvykle připravují těsně před použitím z arylhalogenidů a kovové mědi.
Měďné sloučeniny reagují přímo s arylhalogenidy:
- Ar-X + ROCu → Ar-OR + CuX
- Ar-X + RSCu → Ar-SR + CuX
- Ar-X + 2 RNHCu → Ar-NHR + CuX
Při C-N párování proběhne oxidační adice, po které následuje redukční eliminace měditých meziproduktů:[10]
Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Ullmann condensation na anglické Wikipedii.
- ↑ a b c Florian Monnier; Marc Taillefer. Minireview Catalytic CC, CN, and CO Ullmann-Type Coupling Reactions. Angewandte Chemie International Edition. 2009, s. 6954–6971. DOI 10.1002/anie.200804497.
- ↑ Ray Q. Brewster; Theodore Groening. p-Nitrodiphenyl Ether. Organic Syntheses. 1934, s. 66. DOI 10.15227/orgsyn.014.0066.
- ↑ Elizabeth Buck; Zhiguo J. Song. Preparation of 1-methoxy-2-(4-methoxyphenoxy)benzene. Organic Syntheses. 2005, s. 69. DOI 10.15227/orgsyn.082.0069.
- ↑ C. F. H. Allen; G. H. W. McKee. Acridone. Organic Syntheses. 1939, s. 6. DOI 10.15227/orgsyn.019.0006.
- ↑ H. B. Goodbrand; Nan-Xing Hu. Ligand-Accelerated Catalysis of the Ullmann Condensation: Application to Hole Conducting Triarylamines. Journal of Organic Chemistry. 1999, s. 670–674. DOI 10.1021/jo981804o.
- ↑ C. P. Jones; K. W. Anderson; S. L. Buchwald. Sequential Cu-Catalyzed Amidation-Base-Mediated Camps Cyclization: A Two-Step Synthesis of 2-Aryl-4-quinolones from o-Halophenones. Journal of Organic Chemistry. 2007, s. 7968–7973. DOI 10.1021/jo701384n. PMID 17850097.
- ↑ William Robert Hardy Hurtley. Replacement of Halogen in ortho-Bromobenzoic Acid. J. Chem. Soc.. 1929, s. 1870. DOI 10.1039/JR9290001870.
- ↑ Antoine Nitelet; Sara Zahim; Cédric Theunissen; Alexandre Pradal; Gwilherm Evano. Copper-catalyzed Cyanation of Alkenyl Iodides. Organic Syntheses. 2016, s. 163. DOI 10.15227/orgsyn.093.0163.
- ↑ Roger Adams; Aldo Ferretti. 1,2-Bis(N-butylthio)benzene. Organic Syntheses. 1962, s. 22. DOI 10.15227/orgsyn.042.0022.
- ↑ Ramesh Giri; Andrew Brusoe; Konstantin Troshin; Justin Y. Wang; Marc Font; John F. Hartwig. Mechanism of the Ullmann Biaryl Ether Synthesis Catalyzed by Complexes of Anionic Ligands: Evidence for the Reaction of Iodoarenes with Ligated Anionic CuI Intermediates. Journal of the American Chemical Society. 2018, s. 793–806. DOI 10.1021/jacs.7b11853.
