Kobber(I)klorid
| Kobber(I)klorid | |
|---|---|
 | |
| IUPAC-navn Kobber(I)klorid | |
| Generelt | |
| Molekylformel | CuCl |
| Molarmasse | 98,999 g/mol |
| Fremtræden | hvidt pulver, lettere grønt fra oxiderede urenheder |
| CAS-nummer | |
| PubChem | |
| SMILES | Cl[Cu] |
| InChI | 1/ClH.Cu/h1H;/q;+1/p-1 |
| Kemiske egenskaber | |
| Massefylde | 4,145 g/cm3 3 |
| Opløselighed i vand | 0,0062 g/100 mL (20 °C) |
| Opløselighed | uopløselig i ethanol acetone; opløselig i koncentreret HCl, NH4OH |
| Refraktionsindeks | 1,930[1] |
| Struktur | |
| Krystalstruktur | zinkblendestruktur |
| Sikkerhed | |
| MSDS | JT Baker |
| EU klassifikation | Skadelig (Xn) Farlig for miljøet (N) |
| NFPA 704 | |
| R-sætninger | R22, R50/53HUSK {} |
| S-sætninger | S2, S22, S60, S61 HUSK {} |
| Flammepunkt | Ikke-brandbar |
| LD50 | 140 mg/kg |
| Beslægtede stoffer | |
| Andre anioner | Kobber(I)bromid Kobber(I)iodid |
| Andre kationer | Kobber(II)klorid Sølv(I)klorid |
| Hvis ikke andet er angivet, er data givet for stoffer i standardtilstanden (ved 25 °C, 100 kPa) | |
Kobber(I)klorid er et klorid af kobber med den kemiske formel CuCl. Stoffet er hvidt og på fast form, og det er kun i ringe grad opløseligt i vand, men meget opløseligt i koncentreret saltsyre. Urene prøver forekommer grønne grundet tilstedeværelsen af kobber(II)klorid.[1]
Kemiske egenskaber
[redigér | rediger kildetekst]-
Hvide kobber(I)kloridkrystaller på kobbertråd
-
Kobber(I)klorid
-
Kobber(I)klorid delvist oxideret i luften
Kobber(I)klorid er en Lewissyre, som klassificeres som blød ifølge HSAB-konceptet. Dermed har det tendens til at danne stabile komplekser med bløde Lewisbaser som trifenylfosfan:
- CuCl + P(C6H5)3 → [CuCl(P(C6H5)3)]4
Selvom CuCl er uopløselig i vand opløses det i vandige opløsninger indeholdende passende donormolekyler. Det danner komplekser med halidioner, for eksempel dannes H3O+ CuCl2- med koncentreret saltsyre. Det angribes af CN-, S2O32- og NH3, hvormed der dannes de tilsvarende komplekser.
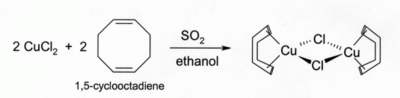
Opløsninger af CuCl i HCl eller NH3 absorberer kulilte og danner farveløse komplekser såsom den kloridforbundne dimer [CuCl(CO)]2. De samme saltsyreopløsninger kan også reagere med acetylengas og danne [CuCl(C2H2)]. Ammoniakopløsninger af CuCl reagerer med acetylener og danner sprængstoffet kobber(I)acetylid. Komplekser af CuCl med alkener kan laves ved reduktion af CuCl2 af svovldioxid i tilstedeværelse af alkenen i alkoholopløsning. Komplekser med diener såsom 1,5-cyklooktadien er særligt stabile:[2]
I fraværet af andre ligander er dets vandige opløsninger ustabile hvad angår disproportionering til Cu og CuCl2.[3] Dels grundet dette antager prøver i luften en grøn farve (se foto for oven til højre).
Brug
[redigér | rediger kildetekst]Kobber(I)klorids primære anvendelse er som forgænger til fungiciden kobberoxyklorid. Til dette formål dannes vandig kobber(I)klorid af komproportionering og bliver dernæst luft-oxideret:
- Cu + CuCl2 → 2 CuCl
- 6 CuCl + 3/2 O2 + 3 H2O → 2 Cu3Cl2(OH)4 + CuCl2
Kobber(I)klorid katalyserer mange organiske reaktioner som diskuteret ovenfor. Dets affinitet for kulilte i tilstedeværelse af aluminiumklorid udnyttes i COPureSM-processen.
I organisk syntese
[redigér | rediger kildetekst]I en Sandmeyerreaktion[4] fører behandling af arendiazoniumsalt med CuCl til et arylklorid, for eksempel:
Reaktionen giver almindeligvis et godt udbytte.
I polymerkemi
[redigér | rediger kildetekst]CuCl bruges som katalysator i Atom transfer radical polymerization (ATRP).
Referencer
[redigér | rediger kildetekst]- ^ United States Patent US4582579 "method of preparing cupric ion free cuprous chloride" Section 2, lines 4-41 , via www.freepatentsonline.com
- ^ Nicholls, D. Complexes and First-Row Transition Elements, Macmillan Press, London, 1973.
- ^ Greenwood, N.N.; Earnshaw, A. Chemistry of the Elements, 2nd ed., Butterworth-Heinemann, Oxford, UK, 1997.
- ^ (a) Wade, L. G. Organic Chemistry, 5th ed., p. 871, Prentice Hall, Upper Saddle RIver, New Jersey, 2003. (b) March, J. Advanced Organic Chemistry, 4th ed., p. 723, Wiley, New York, 1992.
Videre læsning
[redigér | rediger kildetekst]- Mellor, J. W., A Comprehensive Treatise on Inorganic and Theoretical Chemistry, Volume III, pp157-168. Longmans, Green & Co., London, 1967 (new impression).