Illudol
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||
| Allgemeines | |||||||||||||
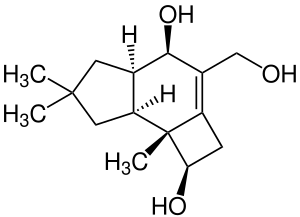
| Name | Illudol | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C15H24O3 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 252,35 g·mol−1 | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
Illudol ist eine organische Verbindung aus der Gruppe der Sesquiterpene, genauer der Protoilludane. Sie weist ein trizyklisches Kohlenstoffgerüst mit einem Vier-, einem Fünf- und einem Sechsring auf.[3] Diese Verbindungen sind besonders durch ihren potentiellen Nutzen in der medizinischen Forschung und für den Pflanzenschutz von Bedeutung.[4] Diese Stoffe, zu denen auch Illudol gehört, haben eine Vielzahl biologischer Wirkungen, darunter antimikrobielle, antimykotische und zytotoxische Eigenschaften.[5]
Entdeckung und Isolation
[Bearbeiten | Quelltext bearbeiten]Illudol wurde 1950 erstmals aus dem Pilz Dunkler Ölbaumtrichterling (Omphalotus olearius) isoliert.[5] Der Pilz stammt aus dem Osten Nordamerikas kommt aber auch in Deutschland vor. Neben Illudol produziert er eine Reihe weiterer Sesquiterpenoide wie Neoilludol und Illudiolon.[5]
All diese Verbindungen spielen eine wichtige Rolle bei der chemischen Verteidigung der Pilze gegen Bakterien. Diese Eigenschaft stellt auch den evolutionsbiologischen Grund für ihr Vorkommen in diesen Pilzen dar.[6] In den letzten Jahrzehnten wurde nicht nur Illudol aus Pilzen isoliert, sondern auch eine Vielzahl weiterer Protoilludane. Diese teilen mit dem Illudol den strukturellen Aufbau und werden ebenfalls in der medizinischen Forschung und der Pestizidentwicklung untersucht.[7]
Struktur
[Bearbeiten | Quelltext bearbeiten]Illudol verfügt über mehrere chiralen Zentren. Fünf von ihnen liegen auf einer Reihe benachbarter Atome und zwei von ihnen (C-3 und C-10) tragen Hydroxylgruppen, deren Konfiguration von der selektiven Carbonylreduktion diktiert wird. Nach der Cahn-Ingold-Prelog-Konvention (CIP) besitzen die Atome C-3, C-4, C-9 und C-10 die (R)-Konfiguration, während C-8 als einziges Chiralitätszentrum die (S)-Konfiguration besitzt. Erstmals wurde die planare Struktur des Illudols 1967 beschrieben, während die absolute Stereochemie erst vier Jahre später (1971) dank der Röntgenkristallographie bestimmt und sogar im selben Jahr noch ein racemisches Gemisch synthetisiert werden konnte.[5]
Biosynthese
[Bearbeiten | Quelltext bearbeiten]
Die Biosynthese nahezu aller Terpene, auch der Sesquiterpenoide, verläuft über den Mevalonatweg, der unter anderem zum Humulen führt.
Wenn Humulen an der richtigen Stelle protoniert wird, kann über den Zwischenschritt des Gemacryl-Kations durch eine weitere Cyclisierung zu einem viergliedrigen Ring ein kationischer Cyclisierungsprozess initiiert werden, der mit dem Protoilludan-Kation, dem zweiten wichtigen Zwischenprodukt, endet. Ausgehend von diesem Protoilludan-Kation können dann Protoilludan, Pasteurestin oder Illudol synthetisiert werden. Im Falle des Illudols ist dafür nur eine finale Oxidation an drei verschiedenen Stellen nötig.[8]
Totalsynthese
[Bearbeiten | Quelltext bearbeiten]
Die Totalsynthese nach Martin F. Semmelhack beginnt ausgehend von Ethylpropionat und 1,1-Diethoxyethylen, ein Molekül, welches zwei Ethoxygruppen, sowie eine C=C-Doppelbindung besitzt. Durch längeres Erhitzen am Rückfluss wird daraus ein Cyclobutenring aufgebaut. Eine weitere Komponente für einen kovergenten Schritt wird über ein Enolat-Anion aus Acetylcyclopenten hergestellt. Dazu wird dieses zunächst mittels einer Amidbase (LiN(R)2) deprotoniert. Dieses Anion kann in vielen verschiedenen Variationen zu einem Dien umgesetzt werden, das maßgeblich an der folgenden Diels-Alder-Reaktionen beteiligt ist, die durch die Verbindung mit dem Cyclobuten zu einem sechsgliedrigen Ring führt. In der Folge wird das entstandene Zwischenprodukt erst zum Enol hydrolysiert und ergibt durch Keto-Enol-Tautomerie ein Keton.[7]
Um die für das Illudol nötigen chemischen Gruppen noch in das bestehende Zwischenprodukt einzuführen, wird zunächst eine Reduktion der Ketogruppe zum Alkohol durchgeführt, welche anschließend mittels einer Schutzgruppe (hier: Benzylbromid) geschützt wird. Diese Reduktion bedarf den Einsatz eines Reduktionsmittels, wie Lithiumtriethylborhydrid, welches Aldehyde und Ketone, selektiv in Gegenwart von Estern reduzieren kann. Als Nächstes werden die Ester-Gruppen zu Methylgruppen umgewandelt. Dieser Prozess beginnt mit der Reduktion der Ester zu Alkoholen unter Einsatz von Lithiumaluminiumhydrid und der anschließenden Deprotonierung der Hydroxylgruppe durch die Verwendung von Butyllithium (n-BuLi) in Tetrahydrofuran (THF) als Lösungsmittel. Darauf folgt dann die Spaltung der C=O-Bindungen mit Hilfe des Reduktionsmittels Lithiumethylamid (LiEtNH) und einer Hydrolyse zu Methylgruppen. Im nächsten Schritt werden nun die Benzylschutzgruppen durch eine Reduktion mit Lithiummetall entfernt und die Hydroxylgruppen freigelegt. Diese Hydroxylgruppen stehen nun wieder für Reaktionen zur Verfügung und werden direkt mittels einer Jones-Oxidation oxidiert.[7]
Der nächste Schritt ist eine Deprotonierung an α-Stelle mittels Lithiumdiisopropylamid, die eine Carboxylierung einleitet, bei der ein Molekül Kohlenstoffdioxid an das Molekül addiert wird. Danach wird die Carbonsäuregruppe bei der Reaktion mit Diazomethan zu einem Methylester umgewandelt. Über mehrere Zwischenschritte folgt danach unter anderem durch Deprotonierung mittels LDA; einer oxidativen Abspaltung des bei der Deprotonierung addierten Lithiums durch das Oxidationsmittel Wasserstoffperoxid, die das nun entfernte Lithium durch eine Hydroxylgruppe ersetzt und der anschließenden Eliminierung der gerade erst addierten Hydroxylgruppe die Bildung einer Doppelbindung.[7]
Für den letzten Reaktionsschritt werden zunächst die beiden Hydroxylgruppen säurekatalysiert (p-Toluolsulfonsäure) mit Aceton geschützt. Es wird eine Acetal-Schutzgruppe gebildet. Nach dieser Schützung kann eine Ether-Gruppe protoniert werden, damit der Ethanol-Rest als Abgangsgruppe vom Molekül abgespalten werden kann. Aus ursprünglichen Ether-Gruppe bildet sich nun eine Keto-Gruppe, die dann im Folgeschritt beim Umsatz mit NaAl(OR)2H2 zu einer Hydroxylgruppe umgewandelt wird. Um die Totalsynthese zu beenden, muss nun nur noch die Acetal-Schutzgruppe mittels einer sauren Hydrolyse mit Salzsäure in THF entfernt werden.[7]
Biologische Wirkung und medizinische Aspekte
[Bearbeiten | Quelltext bearbeiten]Die nützlichen Eigenschaften von Illudol bestehen in seiner antimikrobiellen und antitumoralen Aktivität. Antitumor-Eigenschaften besitzt nicht nur Illudol, sondern weisen auch einige Derivate wie z. B. Illudin-S und Illudin-M auf. Sie beruhen vor allem auf der hohen Zytotoxizität dieser Stoffe.[9] Studien zeigten, dass 23 % der zum jetzigen Zeitpunkt isolierten Protoilludane eine zytotoxische Wirkung auf humane Krebszelllinien haben. Von diesen weisen wiederum 16 % eine moderate oder gar starke Zytotoxizität auf.[5]
Die antimikrobielle Aktivität des Illudol wird auch bei anderen Protoilludanen beobachtet und ist dort teilweise stärker ausgeprägt.[10][11] Illudol ist Gegenstand der pharmazeutischen Wirkstoffforschung.[5][12]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Dictionary of Organic Compounds. Chapman and Hall, S. 403 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Maryse Rychlet Elliott, Anne-Lise Dhimane, Max Malacria: Biomimetic Diastereoselective Total Synthesis of epi -Illudol via a Transannular Radical Cyclizations Strategy. In: Journal of the American Chemical Society. Band 119, Nr. 14, April 1997, S. 3427–3428, doi:10.1021/ja970139i.
- ↑ Peter Siengalewicz, Johann Mulzer, Uwe Rinner: Synthesis of Protoilludanes and Related Sesquiterpenes. In: European Journal of Organic Chemistry. Band 2011, Nr. 35, Dezember 2011, S. 7041–7055, doi:10.1002/ejoc.201101220.
- ↑ a b c d e f Melissa M. Cadelis, Brent R. Copp, Siouxsie Wiles: A Review of Fungal Protoilludane Sesquiterpenoid Natural Products. In: Antibiotics. Band 9, Nr. 12, 19. Dezember 2020, S. 928, doi:10.3390/antibiotics9120928, PMID 33352728, PMC 7765842 (freier Volltext).
- ↑ Alberto Arnone, Rosanna Cardillo, Vincenza Di Modugno, Gianluca Nasini: Secondary mould metabolites. Part 29. Isolation and structure elucidation of candicansol, 3-epi-illudol and 1-O-acetyl-3-epi-illudol, novel sesquiterpenoids from Clitocybe candicans, and absolute configuration of 3-epi-illudol. In: Journal of the Chemical Society, Perkin Transactions 1. Nr. 11, Januar 1989, S. 1995–2000, doi:10.1039/P19890001995.
- ↑ a b c d e M. F. Semmelhack, Shuji Tomoda, K. M. Hurst: Synthesis of (±)-illudol. In: Journal of the American Chemical Society. Band 102, Nr. 25, Dezember 1980, S. 7567–7568, doi:10.1021/ja00545a031.
- ↑ Naoko Morisaki, Jun Furukawa, Hisayoshi Kobayashi, Shigeo Iwasaki, Akiko Itai, Shigeo Nozoe, Shigenobu Okuda: Synthesis of 8-Hydroxy-6-protoilludene, a Probable Biosynthetic Intermediate of Humulene-Derived Sesquiterpenes Produced by Basidiomycetes. In: Chemical & Pharmaceutical Bulletin. Band 33, Nr. 7, 1985, S. 2783–2791, doi:10.1248/cpb.33.2783.
- ↑ Roumyana D. Petrova, Jamal Mahajna, Abraham Z. Reznick, Solomon P. Wasser, Cvetomir M. Denchev, Eviatar Nevo: Fungal substances as modulators of NF-κB activation pathway. In: Molecular Biology Reports. Band 34, Nr. 3, September 2007, S. 145–154, doi:10.1007/s11033-006-9027-5.
- ↑ Gemma Assante, Sabrina Dallavalle, Piera Anna Martino: Protoilludane sesquiterpenoids as scaffold structures for new antimicrobials against Mannheimia haemolytica. In: The Journal of Antibiotics. Band 66, Nr. 1, Januar 2013, S. 43–45, doi:10.1038/ja.2012.90.
- ↑ Erik P. Johnson, K. Peter C. Vollhardt: Stereoselective, one-step assembly of the strained protoilludane framework by cobalt-mediated cyclization of an acyclic enediyne precursor. A total synthesis of illudol. In: Journal of the American Chemical Society. Band 113, Nr. 1, Januar 1991, S. 381–382, doi:10.1021/ja00001a067.
- ↑ Chelsea Massaro: gem-Dimethylcyclopentane-Fused Pharmacophores. In: Florida State University Digital Library. 2016, abgerufen am 6. Juli 2024 (englisch).