Kurs:Strecker-Synthese
|
|
|
Einleitung
[Bearbeiten]Dieser Kurs beleuchtet den Mechanismus der sogenannten Strecker-Synthese. Aus Aldehyden können mit ihr Aminosäuren hergestellt werden. Ein interessanter Aspekt dieser Reaktion ist der Verlust des Carbonyl-Sauerstoffatoms des Aldehyds.
Reaktion
[Bearbeiten]Ausgangspunkt der Synthese ist in unserem Beispiel Acetaldehyd, das in der ersten Reaktion zum instabilen Imin, in der zweiten Reaktion zum α-Aminonitril und in der dritten Reaktion schließlich zur α-Aminosäure reagiert.

Die Mechanismen der einzelnen Reaktionsschritte gehen wir im Folgenden detailliert durch.
Mechanismus
[Bearbeiten]1. Bildung des Halbaminals bzw. Imins
[Bearbeiten]Im ersten Schritt greift Ammoniak nukleophil am Carbonylkohlenstoffatom an.

In Bezug auf Carbonylgruppen ist Ammoniak bzw. ein Amin (R–NH2) ein gutes Nukleophil. Ketone oder wie in diesem Fall Aldehyde sind dementsprechend elektrophil. Aufgrund dieses guten Zusammenspieles zwischen Nukleophilie und Elektrophilie ist ein Katalysator überflüssig. NH3 greift also einfach nukleophil an und nach anschließender Wanderung eines Protons vom positiv geladenen Stickstoffatom zum negativ geladenen Sauerstoffatom erhält man ein Halbaminal.
|
Info: Protonierung von Aminen senkt deren Nukleophilie
Ein Säurekatalysator würde sogar die Reaktion behindern, da das Amin bzw. Ammoniak als Kation durch die Protonierung dem Gleichgewicht entzogen werden würde. Der nukleophile Charakter der Kationen ist nur noch so gering, dass die Reaktion extrem langsam abliefe.  |
Erst im Schritt der eigentlichen Imin-Bildung wird eine Säure als Katalysator benötigt.

Durch die Protonierung durch die Säure wird die OH-Gruppe zur guten Abgangsgruppe H2O. Nach der Dehydratisierung wird ein Proton am positiv geladenen Stickstoff abgespalten. Man erhält ein Imin. In diesem Schritt wird also durch Wasserabspaltung der Sauerstoff, der vorher zur Carbonylgruppe gehörte, entfernt. In der Gesamtreaktion wurde letztendlich der doppelt gebundene Sauerstoff gegen den doppelt gebundenen Stickstoff ausgetauscht. Jetzt weißt du auch, wie das funktioniert.
Ein Problem ergibt sich im Zusammenspiel dieser beiden Schritte: Im ersten Schritt behindert Säurezugabe die Reaktion zum Halbaminal, im zweiten Schritt aber wird eine Säure als Katalysator für die Imin-Bildung benötigt. Man hat herausgefunden, dass im Sauren unter einem pH-Wert von 4 der erste Schritt sehr langsam abläuft und bei einem pH-Wert über 6 der zweite Schritt aufgrund des zu basischen Milieus sehr langsam abläuft. Das Optimum liegt somit bei einem pH-Wert von 4-6.
2. Nukleophile Addition zum Nitril
[Bearbeiten]Das α-Aminonitril bildet sich durch eine einfache nukleophile Addition des Cyanid-Anions an das doppelt gebundene C-Atom, das sich am Stickstoff befindet.

Durch das vorherige Protonieren des Imins zum Iminium-Ion wird der anzugreifende Kohlenstoff elektrophiler gemacht. Der nukleophile Angriff des Cyanids wird dadurch erleichtert.
3. Reaktion zur Aminosäure
[Bearbeiten]In nächsten Schritt muss die Nitrilgruppe im Sauren hydrolysiert werden. Im Prinzip wird nur Wasser an die protonierte Nitrilgruppe addiert. Bis auf den zweiten Schritt handelt es sich bei allen anderen Schritten jeweils um eine simple Protonenwanderung.

Im ersten Schritt wird der Stickstoff der Nitrilgruppe protoniert und da es sich um eine sauer katalysierte Hydrolyse handelt, wird im letzten Schritt der Katalysator, also das Proton, wieder abgespalten. Wir erhalten ein Amid.
|
Info: Dehydratisierung von Amiden
Nitrile kann man übrigens auch als Amide betrachten, die ein Molekül Wasser verloren haben:  Mit einem stark hygroskopischen Stoff, d. h. einer sehr stark wasserbindenden Verbindung wie Phosphorpentoxid, kann man einem Amid tatsächlich das Wasser auf direktem Weg entziehen:  Bei unserer Hydrolyse passiert genau das Umgekehrte: Wir addieren Wasser an das Nitril. |
Jetzt fehlt nur noch eine erneute Hydrolyse, um zur α-Aminosäure zu kommen.

Die Protonierung an Amiden (–CONH) erfolgt im Gegensatz zu Aminen (–NH2) immer am Carbonylsauerstoffatom.
|
Info: Mesomeriestabilisierung
Der Grund hierfür ist die Delokalisierung des Elektronenpaars. Nur wenn das Sauerstoffatom protoniert wird, erhält man ein Kation, bei dem eine solche Delokalisierung möglich ist. Bei Protonierung am Sauerstoff wird also die positive Ladung (bzw. ein Elektronenpaar) über O und N delokalisiert. So ein Kation ist stabiler als ein Kation, bei dem keine Delokalisierung stattfindet. 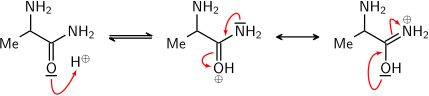 Würde das Stickstoffatom protoniert werden, wäre keine Mesomeriestabilisierung möglich. Dementsprechend entsteht ein solches Zwischenprodukt gar nicht erst. 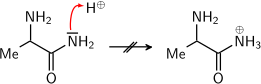 |
Nachdem die Carbonylgruppe durch die Säure protoniert wurde, ist das entsprechende C-Atom so elektrophil, dass Wasser nukleophil angreifen und sich das tetraedrische Intermediat bilden kann. Jetzt ist keine Delokalisierung des freien Elektronenpaares von Stickstoff mehr möglich und dadurch hat jetzt der Stickstoff eine höhere Basisizität als die benachbarten Sauerstoffatome der OH-Gruppen. Also wird erst jetzt der Stickstoff protoniert, wodurch sich Ammoniak als gute Abgangsgruppe bildet. Und da wir uns im stark sauren Milieu befinden, wird auch sofort Ammoniak protoniert. Die Nukleophilie des Ammonium-Ions ist nun so gering, dass es praktisch nicht mehr mit der Carboxylgruppe reagiert. Das Prinzip ist hier wieder das selbe wie bei der oben geschilderten Imin-Bildung (siehe oberste Info-Box zur Protonierung von Aminen). Das chemische Gleichgewicht liegt auf der Seite der Aminosäure. Eine Rückreaktion findet praktisch nicht statt.
Zusammenfassung
[Bearbeiten]Mit der Bildung der α-Aminosäure wurde ein neues Chiralitätszentrum generiert. Allerdings ist die Strecker-Synthese nicht stereospezifisch, da als Edukte und Reagenzien ausschließlich achirale Verbindungen verwendet werden, sodass man lediglich ein racemisches Gemisch aus der L- und D-Aminosäure erhält.

Die Strecker-Synthese ist daher nicht besonders geeignet für die Synthese von Aminosäuren, da man aufgrund des Enantiomerengemisches praktisch nur eine maximale Ausbeute von 50 % erhält. Eine Trennung der Enantiomere ist zudem ziemlich aufwendig. Zum Beispiel das enantiomerenreine L-Alanin kann man deutlich einfacher durch die Hydrolyse von natürlich vorkommenden Proteinen gewinnen. Für die Synthese einer nicht-proteinogenen Aminosäure wie Phenylglycin wäre die Strecker-Synthese da schon interessanter:

Aber in diesem Kurs geht es nicht primär um den praktischen Nutzen der Strecker-Synthese, sondern um die Chemie, die dahinter steckt. Du hast nämlich zahlreiche organische Reaktionen gesehen und näher kennengelernt:
|
Die einzelnen Reaktionen der Strecker-Synthese
|
Übung
[Bearbeiten]- Schaue dir noch einmal den Mechanismus für die gesamte Strecker-Synthese von Alanin aus Acetaldehyd an. Versuche anschließend, den Mechanismus für die Strecker-Synthese von Phenylglycin aus Benzaldehyd aufzuschreiben. Nenne die Stoffklasse des Ausgangsstoffes und des Produktes sowie aller wichtigen Intermediate. Benenne alle fünf Reaktionen. Den Phenylrest darfst du mit „Ph“ abkürzen. (Lösung)

Weiterführende Literatur
[Bearbeiten]- J. Clayden, N. Greeves, S. Warren: Organic Chemistry, Oxford University Press, Oxford, 2. Aufl., 2012, ISBN 978-0199270293, S. 212-214, S. 230 f., S. 236, S. 307 f.
