Eupolauridina
Apariencia
| Eupolauridina | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
| 1,6-Diazafluoranteno | ||
| General | ||
| Fórmula estructural |
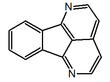 | |
| Fórmula molecular | C14H8N2 | |
| Identificadores | ||
| Número CAS | 58786-39-3[1] | |
| ChEBI | 67605 | |
| ChEMBL | CHEMBL477708 | |
| ChemSpider | 65398 | |
| PubChem | 72486 | |
| UNII | M3LXQ9G7MF | |
| Propiedades físicas | ||
| Masa molar | 204,231 g/mol | |
| Punto de fusión | 156 °C (429 K) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
La eupolauridina es un alcaloide diazaflourantrénico aislado de Eupomatia laurina, Ambavia gerrardii, Cleistopholis patens y Cananga odorata (ylang ylang).[2] Provoca inhibición en levaduras.[3] UV: [neutro]λmax228 (log ε4.33) ;233 (log ε4.34) ;278 (log ε4.23) ;288 (log ε4.2) ;296 (log ε3.98) ;335 (log ε3.57) ;350 (log ε3.81) ;367 (log ε3.8) ( EtOH)[4] por acción en topoisomerasas I.[5]
Derivados
[editar]| Nombre | Derivado | Fórmula molecular | CAS | Masa molecular (g/mol) | Estado | Fuente natural | Otras propiedades |
|---|---|---|---|---|---|---|---|
| N-óxido de eupolauridina | N-óxido | C14H8N2O | 96889-95-1 | 220.230 | Escamas naranjas (cloroformo) PF = 187 °C | Aislado de Ambavia gerrardii y Cleistopholis patens[6] | |
| N,N' dióxido de eupolauridina | N,N' dióxido | C14H8N2O2 | 96889-96-2 | 236.229 | Escamas naranjas (MeOH) PF = 190 - 195 °C | Aislado de Cleistopholis patens junto con el N óxido. | UV: [neutral]λmax230 (log ε3.96) ;250 (log ε4.24) ;295 (log ε4.3) ;405 (log ε3.62) ;440 (log ε3.64) (MeOH) |
| 3-Metoxieupolauridina | 3-Metoxi | C15H10N2O | 139220-17-0 | 234.257 | Agujas amarillas PF = 167 °C | Aislado de la corteza de Eupomatia laurina[7] | UV: [neutral]λmax216 (ε21880) ;226 (ε21380) ;237 (ε23440) ;285 (ε9120) ;298 (ε12020) ;306 (ε12880) ;320 (ε6760) ;341 (ε3800) ;358 (ε6030) ;376 (ε6310) (EtOH) |
Síntesis
[editar]La síntesis de derivados de eupaularidina de acuerdo a Pan y colaboradores, consiste en el siguiente esquema sintético:[8]
- Se parte de 3-(4-metoxifenil)-3-oxopropanoato de metilo, el cual reacciona con (2E)-but-2-enal (Crotonaldehído) con hidruro de sodio como base.
- Con hidroxilamina en medio ácido se forma el anillo de piridina.
- Se hidroliza el éster etílico.
- Con cloruro de tionilo se gerenar el cloruro de acilo y con cloruro de aluminio se lleva a cabo una acilación de Friedel-Crafts intramolecular.
- Se condensa una unidad de carbono con dimetil formamida y 1,1-dietoxi-N,N-dimetilmetanamina para formar el anillo de isoquinolina. En este paso se forma la Eupolauridina. Por oxidación con ácido metacloroperbenzoico se forman los N-óxidos.

Referencias
[editar]- ↑ Número CAS
- ↑ Leboeuf, M. et al., Ann. Pharm. Fr., 1975, 33, 43- 47
- ↑ Hufford, C.D. et al., J. Nat. Prod., 1987, 50, 961- 964
- ↑ Bowden, B.F. et al., Aust. J. Chem., 1972, 25, 2659- 2669; 1975, 28, 2681- 2701
- ↑ Khan et al.(2002) Antimicrobial Agents and Chemotherapy 46 (6) , pp. 1785-1792.
- ↑ Waterman, P.G. et al., Phytochemistry, 1985, 24, 523- 527
- ↑ Carroll, A.R. et al., Aust. J. Chem., 1991, 44, 1615- 1626
- ↑ Pan et al. J. Nat. Prod. 2011, 74, 1169–1174
