Polifosfato de amonio
| Polifosfato de amonio | ||
|---|---|---|
| General | ||
| Fórmula estructural |
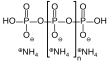 | |
| Fórmula molecular | H(NH4PO3)nOH | |
| Identificadores | ||
| Número CAS | 68333-79-9[1] | |
El polifosfato de amonio es una sal inorgánica de ácido polifosfórico y amoníaco que contiene cadenas y posiblemente ramificaciones. Su fórmula química es H(NH4PO3)nOH mostrando que cada monómero consiste en un radical ortofosfato de un átomo de fósforo con tres oxígenos y una carga negativa neutralizada por un catión amonio dejando dos enlaces libres para polimerizar. En los casos ramificados, algunos monómeros carecen del anión amonio y en su lugar se enlazan con otros tres monómeros.
Las propiedades del polifosfato de amonio dependen del número de monómeros de cada molécula y, en cierta medida, de la frecuencia con la que se ramifica. Las cadenas más cortas (n < 100) son más sensibles al agua y menos estables térmicamente que las cadenas más largas (n > 1000),[2]pero las cadenas cortas de polímeros (por ejemplo, piro-, tripoli- y tetrapoli-) son más solubles y muestran una solubilidad creciente con el aumento de la longitud de la cadena.[3]
El polifosfato de amonio puede prepararse haciendo reaccionar ácido fosfórico concentrado con amoníaco. Sin embargo, las impurezas de hierro y aluminio, solubles en ácido fosfórico concentrado, forman precipitados gelatinosos o "lodos" en el polifosfato de amonio a pH entre 5 y 7.[4]Otras impurezas metálicas como cobre, cromo, magnesio y zinc forman precipitados granulares.[5] Sin embargo, dependiendo del grado de polimerización, el polifosfato de amonio puede actuar como agente quelante para mantener disueltos ciertos iones metálicos.[6]
El polifosfato de amonio se utiliza como aditivo alimentario, emulsionante (número E: E545) y como fertilizante.
El polifosfato de amonio (APP, por sus siglas en inglés) también se utiliza como retardante de llama en muchas aplicaciones, como pinturas y revestimientos, y en diversos polímeros: los más importantes son las poliolefinas y, en particular, el polipropileno, donde el APP forma parte de sistemas intumescentes.[7] [8]Otras aplicaciones son los termoestables, donde el APP se utiliza en poliésteres insaturados y gel coats (mezclas de APP con sinergistas), epoxis y coladas de poliuretano (sistemas intumescentes). El APP también se aplica a espumas de poliuretano ignífugas.
Los polifosfatos de amonio utilizados como retardantes de llama en polímeros tienen cadenas largas y una cristalinidad específica (Forma II). Comienzan a descomponerse a 240 °C para formar amoniaco y ácido fosfórico. El ácido fosfórico actúa como catalizador ácido en la deshidratación de polialcoholes a base de carbono, como la celulosa de la madera. El ácido fosfórico reacciona con grupos de alcohol para formar ésteres de fosfato termoestables. Los ésteres se descomponen para liberar dióxido de carbono y regenerar el catalizador de ácido fosfórico.
En la fase gaseosa, la liberación de dióxido de carbono no inflamable ayuda a diluir el oxígeno del aire y los productos de descomposición inflamables del material que se está quemando. En la fase condensada, la carbonilla resultante ayuda a proteger el polímero subyacente del ataque del oxígeno y del calor radiante.[9] El uso como intumescente se consigue cuando se combina con materiales a base de almidón como el pentaeritritol y la melamina como agentes expansores.[10][11]
Referencias
[editar]- ↑ Número CAS
- ↑ «Copia archivada». Archivado desde el original el 22 de mayo de 2010. Consultado el 20 de noviembre de 2023.
- ↑ US 4041133, Young, Donald C., "Ammonium polyphosphate production", published 1977-08-09, assigned to Union Oil Co. of California
- ↑ US 4721519, Thomas, William P. & Lawton, William S., "Stable ammonium polyphosphate liquid fertilizer from merchant grade phosphoric acid", published 1988-01-26, assigned to American Petro Mart Inc.
- ↑ US 3044851, Young, Donald C., "Production of ammonium phosphates and product thereof", published 1962-07-17, assigned to Collier Carbon & Chemical Co.
- ↑ Gowariker, Vasant; Krishnamurthy, V. N.; Gowariker, Sudha; Dhanorkar, Manik; Paranjape, Kalyani (8 de abril de 2009). The Fertilizer Encyclopedia. John Wiley & Sons. ISBN 9780470431764. Consultado el 30 de junio de 2018 – via Google Books.
- ↑ Weil, E.D., Levchik, S.V. Flame retardants for plastics and textiles, p. 16. Hanser Publishers, Munich, Germany, 2009
- ↑ «As a flame retardant». Mindfully.org. Archivado desde el original el 13 de septiembre de 2007. Consultado el 30 de junio de 2018.
- ↑ US 4515632, Maurer, Alexander & Staendeke, Horst, "Activated ammonium polyphosphate, a process for making it, and its use", published 1985-05-07, assigned to Hoechst AG
- ↑ Camino, G.; Luda, M.P. Mechanistic study of intumescence, p. 48 f, in Le Bras, M.; Camino, G.; Bourbigot, S.; Delobel, R. Eds., Fire retardancy of polymers; The use of intumescence, The Royal Society of Chemistry, Cambridge, UK, 1998
- ↑ Bourbigot, S.; Le Bras, M. Intumescence flame retardants and char formation, p. 139 f, in Troitzsch, J. Ed. Plastics flammability handbook, 3rd Ed., Hanser Publishers, Munich, 2004
Enlaces externos
[editar]- Specialchem4polymers.com Archivado el 4 de octubre de 2014 en Wayback Machine.
- US 2950961, Striplin Jr., Marcus M.; Stinson, John M. & Potts, John M., "Production of liquid fertilizers", published 1960-08-30, assigned to Tennessee Valley Authority
- US 4211546, Jensen, William C., "Process for preparation of ammonium polyphosphate", published 1980-07-08, assigned to Western Farm Services Inc.
- Esta obra contiene una traducción derivada de «Ammonium polyphosphate» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.
