Trifenilfosfano
| Trifenilfosfano | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| Trifenilfosfano[1] | ||
| General | ||
| Fórmula estructural |
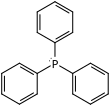 | |
| Fórmula molecular | C18H15P | |
| Identificadores | ||
| Número CAS | 603-35-0[2] | |
| Número RTECS | SZ3500000 | |
| ChEBI | 183318 | |
| ChEMBL | CHEMBL1448331 | |
| ChemSpider | 11283 | |
| PubChem | 11776 | |
| UNII | 26D26OA393 | |
|
c1ccccc1P(c2ccccc2)c3ccccc3
| ||
| Propiedades físicas | ||
| Apariencia | Sólido blanco | |
| Densidad | 1,1 kg/m³; 0,0011 g/cm³ | |
| Masa molar | 262,091 g/mol | |
| Punto de fusión | 80 °C (353 K) | |
| Punto de ebullición | 377 °C (650 K) | |
| Índice de refracción (nD) | 1.59; εr, etc. | |
| Propiedades químicas | ||
| Acidez | 7.64[3] (pKa de ácido conjugado en acetonitrilo) pKa | |
| Solubilidad en agua | Insoluble | |
| Solubilidad | solventes orgánicos | |
| Momento dipolar | 1.4 - 1.44 D[4] D | |
| Peligrosidad | ||
| SGA |
  | |
| Punto de inflamabilidad | 180 K (−93 °C) | |
| NFPA 704 |
1
2
2
| |
| Frases H | H302, H317, H350, H412 | |
| Frases P |
P201, P202, P261, P264, P272, P273, P280,P281,P301+312,P302+352,P308+313, P321, P330,P333+313,P363,P405,P501 | |
| Riesgos | ||
| LD50 | 750 mg/kg (rata, oral); 4.000 mg/kg (conejo, dérmico) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El trifenilfosfano (nombre aceptado por la IUPAC, tradicionalmente llamado trifenilfosfina) es un sólido incoloro, insoluble en agua y soluble en muchos disolventes orgánicos apolares como el benceno, y polares como el diclorometano, el cloroformo etc. Consta de un átomo de fósforo (III) unido a tres grupos fenilo. En disolución al aire el fósforo es oxidado lentamente para dar óxido de trifenilfosfina.
Síntesis
[editar]En el laboratorio se puede obtener a partir de tricloruro de fósforo y bromuro de fenilmagnesio:
PhBr + Mg -> PhMgBr
3 PhMgBr + PCl3 -> PPh3 + 3 MgBrCl
Variantes de esta reacción sirven también para obtener una gran variedad de fosfinas parecidas. A escala técnica se genera más convenientemente por la sustitución electrofílica directa de benceno con tricloruro de fósforo en presencia de un ácido de Lewis como catalizador:
3 C6H6 + PCl3 -> PPh3 + 3 HCl
Como subproductos se obtienen así el cloruro de difenilfosfina (Ph2PCl) y el dicloruro de fenilfosfina (PhPCl2) que pueden ser separados por destilación y sirven de productos de partida en otras reacciones de síntesis.
Reactividad
[editar]El fósforo del fosfano es fácilmente oxidable y produce ya en disolución al aire el óxido de trifenilfosfina por autooxidación. Con los halógenos cloro y bromo da los dihalogenuros correspondientes:
PPh3 + X2 -> X2PPh3
Estos se utilizan como medios suaves de oxidación o en el intercambio de halogenuros.
Con halogenuros de alquilo como por ejemplo el ioduro de metilo se producen sales de fosfonio.
Si estos presentan un hidrógeno en posición alfa al fósforo este puede ser arancado con una base fuerte (en el ejemplo hidruro de sodio)para dar un iluro que se utiliza como producto de partida por ejemplo en reacciones de Wittig. Estas reacciones son importantes para la obtención de olefinas como la vitamina A.
En química inorgánica y química organometálica la trifenilfosfina es un ligando importante que se une al metal a través del par de electrones libre sobre el fósforo. Tiene un comportamiento parecido al monóxido de carbono (aún más parecido es el trifluoruro de fósforo) y puede sustituirlo en diversos complejos metálicos, sobre todo con el átomo central en bajos estados de oxidación. Modificando así las características químicas se tiene acceso a numerosos catalizadores ampliamente utilizados, por ejemplo, en las reacciones de hidroformilación etc.
Con algunos metales reacciona no solo a través del átomo de fósforo, sino que se obtienen reacciones de orto-metalación donde el metal se une además a través del carbono en posición orto al fósforo. Los productos de nuevo pueden ser catalíticamente activos.
Ligando trifenilfosfina
[editar]La trifenilfosfina (PPh3) es un ligando de campo fuerte según la serie espectroquímica de la teoría de campo cristalino y está formado por tres fenilos unidos covalentemente a un átomo de fósforo, el cual tiene dos electrones libres siendo así una base de Lewis que dona dichos electrones en la coordinación al metal central. Debido a su comportamiento como ligando de campo fuerte en algunos complejos con estructura de bajo espín se produce el efecto de retrodonación, es decir, el metal «devuelve» los electrones que tiene a su alrededor debido a la extensa densidad electrónica que le es aportada por los ligandos. El carácter retrodonador produce modos vibracionales no solo en el complejo, sino también en el propio ligando donde participan los tres fenilos, haciendo que la espectroscopia de infrarrojos sea muy útil para identificar la estructura de los complejos con PPh3.
Referencias
[editar]- ↑ International Union of Pure and Applied Chemistry (2014). Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. The Royal Society of Chemistry. p. 431. ISBN 978-0-85404-182-4. doi:10.1039/9781849733069.
- ↑ Número CAS
- ↑ Haav, Kristjan; Saame, Jaan; Kütt, Agnes; Leito, Ivo (2012). «Basicity of Phosphanes and Diphosphanes in Acetonitrile». European Journal of Organic Chemistry 2012 (11): 2167-2172. ISSN 1434-193X. doi:10.1002/ejoc.201200009.
- ↑ Warchol, M.; Dicarlo, E. N.; Maryanoff, C. A.; Mislow, K. (1975). «Evidence for the Contribution of the Lone Pair to the Molecular Dipole Moment of Triarylphosphines». Tetrahedron Letters 16 (11): 917-920. doi:10.1016/S0040-4039(00)72019-3.


