Bleu d'indanthrène
| Bleu d'indanthrène | ||
| ||
 | ||
| Identification | ||
|---|---|---|
| Nom systématique | 6,15-dihydrodinaphto[2,3-a:2',3'-h]phénazine-5,9,14,18-tétrone | |
| Synonymes |
indanthrène, indanthrone, Vat blue 4, Pigment Blue 60, Navinone Blue, C.I. 69800 |
|
| No CAS | ||
| No ECHA | 100.001.251 | |
| PubChem | 6690 | |
| No E | E130 | |
| SMILES | ||
| InChI | ||
| Apparence | poudre bleue[1] | |
| Propriétés chimiques | ||
| Formule | C28H14N2O4 [Isomères] |
|
| Masse molaire[2] | 442,421 8 ± 0,025 g/mol C 76,01 %, H 3,19 %, N 6,33 %, O 14,47 %, |
|
| Propriétés physiques | ||
| T° fusion | 470 à 500 °C (décomposition)[3] | |
| Solubilité | >1 g l−1 (eau, 21,1 °C)[3] pratiquement insoluble dans les solvants organiques[1] soluble dans l'aniline[4] |
|
| Précautions | ||
| SGH[5] | ||
| – | ||
| Unités du SI et CNTP, sauf indication contraire. | ||
| modifier |
||
Le bleu d'indanthrène ou bleu d'indanthrone (Colour Index PB60) est un pigment anthraquinonique de teinte bleu vif à tendance rougeâtre. L'appellation « indanthrène » est une marque commerciale, dont l'usage n'implique pas rigoureusement qu'il s'agit d'un pigment d'indanthrone.
Dans les nuanciers de marchands de couleurs, il est illustré par :
| 039 bleu indien[6] | 585 Bleu d'indanthrène[7] | 395 Bleu d'Indanthrene[8] |
Il est également utilisé en recherche et développement pour ses propriétés catalytiques et optiques.
Histoire
[modifier | modifier le code]Le chimiste franco-germano-suisse René Bohn effectuait des recherches sur la synthèse de l'indigo pour le compte de BASF. Il a découvert cette substance en 1901 et l'a nommée « indanthrène » par contraction de l'allemand Indigo aus Anthracen, c'est-à-dire « indigo [fabriqué] à partir d'anthracène », qui le décrit sommairement[9],[10]. Il est le premier colorant de cuve synthétique de la famille des colorants anthraquinoniques.
Amélioré dans les années 1920, il prend l'appellation Bleu brillant indanthrone R, tandis qu'une série de dérivés sont proposés pour la teinture.
Au plus tard en 1928, le colorant est transformé en pigment. Le Colour Index distingue deux pigments bleus d'indanthrone, PB60 (69 800) et PB64 (69 825) (PRV1).
Il est apparu sous le nom de bleu indien dans le catalogue de la maison Lefranc (aujourd'hui Lefranc & Bourgeois) de 1934.
Comme teinture de textiles, le bleu d'indranthène a fait l'objet d'une forte publicité comme bleu « grand teint », résistant à la lessive bouillante, dans les années 1930.
Propriétés
[modifier | modifier le code]Le bleu d'indanthrène a pour formule brute C28H14N2O4. Chimiquement, il peut être vu comme un dérivé du naphto[2,3-c]pentaphène, un hydrocarbure aromatique polycyclique, mais il est plus justement décrit comme le dimère cyclisé de la 2-aminoanthraquinone, à partir de laquelle il est synthétisé. Il se présente sous la forme d'une poudre bleue qui fond et se décompose vers 470 à 500 °C, pratiquement insoluble dans l'eau et la plupart des solvants organiques (alcool, éther, acétone, benzène), mais soluble dans l'aniline[4]. Il est combustible mais peu inflammable, et ne présente aucun risque en particulier selon le SGH[5]. Il existe sous la forme de quatre structures cristallines (α,β,γ,δ), la forme α étant la plus stable.
C'est un semi-conducteur organique de la classe des molécules conjuguées et un absorbeur de lumière non linéaire.
Synthèse
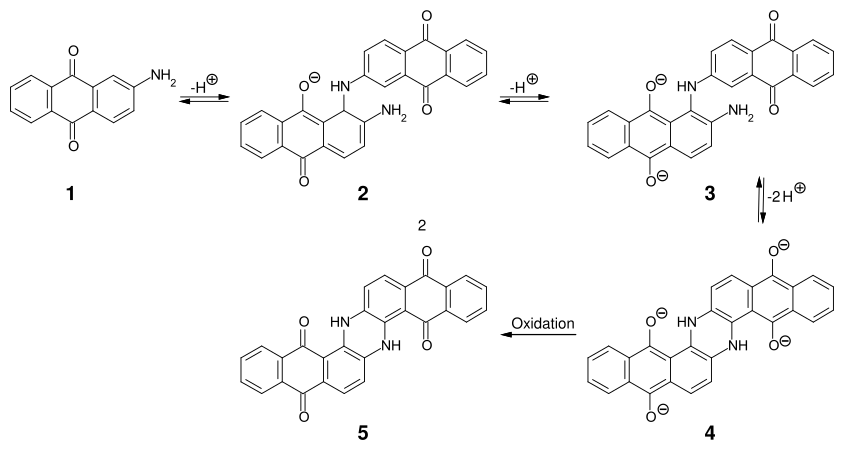
[modifier | modifier le code]La synthèse présentée ici est la synthèse originale découverte par René Bohn en 1901. Elle consiste en la dimérisation de la 2-aminoanthraquinone (1) dans des conditions fortement alcalines à 220-235 °C qui donne l'intermédiaire 3 en deux étapes. Ce dernier se cyclise intramoléculairement, puis et est oxydé en indanthrène (5)[11].
Utilisations
[modifier | modifier le code]Colorant
[modifier | modifier le code]Le bleu d'indanthrène est évidemment utilisé comme pigment bleu (C.I. Pigment Blue 60) et comme colorant de cuve (C.I. Vat Blue 4)[12]. Il se caractérise par sa transparence et son fort pouvoir colorant.
Il est un des colorants de cuve synthétiques possédant les propriétés de solidité les plus élevées pour la teinture et l'impression, en particulier pour les fibres textiles à base de cellulose. Les fibres teintes à l'indanthrène répondent aux normes les plus élevées et ont d'excellentes propriétés de résistance au lavage, à l'ébullition, à la lumière, aux intempéries et au chlore. Il résiste bien à la chaleur jusqu'à 150 °C. Il sert, grâce à ces qualités, dans la peinture d'automobiles. Chauffé à 180 °C, il vire au vert.
Beaucoup plus cher (dix fois) qu'un bleu phtalo, dont le pouvoir colorant est supérieur, son utilisation est cependant en baisse.
Colorant alimentaire
[modifier | modifier le code]Sous le nom de « bleu solanthrène », « bleu anthraquinonique » ou « manascorubine », il correspond au colorant alimentaire E130 utilisé pour l'azurage du sucre et du sel[13]. Il est cependant interdit pour cet usage en Europe. En cosmétique, il est utilisé sous la dénomination C.I. 69800. On le rencontre enfin dans certains pigments ou teintures[14].
Semi-conducteur organique
[modifier | modifier le code]Pour ses propriétés de semi-conducteur organique, l'indanthrone peut, par exemple, être utilisé comme photocatalyseur pour la production d'oxygène à partir de l'eau en utilisant l'énergie solaire[15],[16]. En outre, l'indanthrone peut être utilisée comme limiteur optique, par exemple dans les filtres de protection laser, en raison de sa propriété d'absorbeur de lumière non linéaire[17].
Notes et références
[modifier | modifier le code]- The Merck Index, 9e éd., Rahway, New Jersey, Merck & Co., 1976, p. 653.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- National Toxicology Program, Institute of Environmental Health Sciences, National Institutes of Health (NTP). 1992. National Toxicology Program Chemical Repository Database. Research Triangle Park, Caroline du Nord.
- Weast, R.C. (éd.), Handbook of Chemistry and Physics, 60e éd., Boca Raton, Floride, CRC Press, 1979, p. C-348.
- Entrée « 6,15-Dihydroanthrazine-5,9,14,18-tetrone » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 20 décembre 2020 (JavaScript nécessaire).
- PB60. Ton moyen. Concentré, le pigment est presque noir. « Guide de la peinture à l'huile », sur lefranc-bourgeois.com.
- PB60, même observation. « Nuancier aquarelle », sur rembrandt.royaltalens.com.
- PB60, même observation. « Nuancier Aquarelle Extra-Fine », sur magasinsennelier.com.
- (de) « Indanthron-Pigmente », sur Römpp Online, Georg Thieme Verlag (consulté le )
- (en) Heinrich Zollinger, Color chemistry : syntheses, properties, and applications of organic dyes and pigments, Weinheim, Wiley-VCH Verlag, , 3e éd., 637 p. (ISBN 3-906390-23-3, lire en ligne), p. 255.
- (en) Heinrich Zollinger, Color chemistry : syntheses, properties, and applications of organic dyes and pigments, Weinheim, Wiley-VCH Verlag, , 3e éd., 637 p. (ISBN 3-906390-23-3, lire en ligne), p. 289.
- W. Herbst et K. Hunger, Industrielle Organische Pigmente. Herstellung, Eigenschaften, Anwendung, 2. Aufl., Wiley-VCH, Weinheim, 1995 (ISBN 3-527-28744-2).
- R. Fabre, « Rapport concernant la révision de l'arrêté du 28 juin 1912 sur la coloration des denrées alimentaires », Bulletin de l'Académie nationale de médecine, , p. 417 (lire en ligne) conclut à son innocuité ; Hugues Gounelle de Pontanelle, « Rapport — Les colorants utilisés en technologie alimentaire », Bulletin de l'Académie nationale de médecine, , p. 421 (lire en ligne) conclut à sa nocivité.
- Fiche, sur additifs-alimentaires.net.
- C. A. Linkous et D. K. Slattery, « Solar photocatalytic hydrogen production from water using a dual bed photosystem », Proceedings of the 2000 Hydrogen Program Annual Review, Volume I, (lire en ligne).
- D. K. Slattery et al., « Semiempirical MO and Voltammetric estimation of ionization potentials of organic pigments. Comparison to gas phase ultraviolet photoelectron spectroscopy », Dyes and Pigments, vol. 49, , p. 21–27 (DOI 10.1016/S0143-7208(01)00009-2).
- Y.-P. Sun et J. E. Riggs, « Organic and inorganic optical limiting materials. From fullerenes to nanoparticles », International Reviews in Physical Chemistry, vol. 18, no 1, , p. 43–90 (DOI 10.1080/014423599230008).
Voir aussi
[modifier | modifier le code]Bibliographie
[modifier | modifier le code]- Jean Petit, Jacques Roire et Henri Valot, Encyclopédie de la peinture : formuler, fabriquer, appliquer, t. 1, Puteaux, EREC, , p. 381-382
