Implant cochléaire
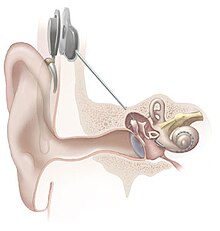
L'implant cochléaire est un implant électronique qui vise à fournir un certain niveau d'audition pour certaines personnes atteintes d'une surdité profonde (surdités endocochléaires profondes) ou sévère et pour des personnes souffrant d'acouphènes. Des électrodes posées chirurgicalement permettent de stimuler directement les terminaisons nerveuses de l'audition situées dans la cochlée[1].
Objectifs
[modifier | modifier le code]Les implants cochléaires peuvent aider à fournir une audition partielle chez les patients dont la surdité est due à des dommages ou à l’absence totale de cils sensoriels dans la cochlée. La qualité du son est différente de celle obtenue par l'audition naturelle, car moins d'informations sonores sont transmises au cerveau. L'implant cochléaire ne fonctionne donc pas dans les cas de surdités dues à l’absence de nerf vestibulocochléaire, mais il peut permettre parfois la transmission parcellaire de quelques informations auditives dans les cas où ce nerf est sévèrement endommagé. Les résultats d'une implantation varient selon les patients et leur surdité, mais elle peut permettre dans les meilleurs cas de fournir une audition suffisante pour permettre la compréhension orale spontanée, des sons ambiants ou permettre des conversations au téléphone. Les implants les plus récents[Quand ?] peuvent permettre une audition améliorée dans les environnements bruyants, d'écouter de la musique, tout en autorisant par exemple la baignade en eau peu profonde.[réf. souhaitée]
Un suivi et un apprentissage, auprès d'un orthophoniste, sont nécessaires après la pose de l'implant. Le cerveau demande une période d'adaptation pour apprendre à identifier les informations reçues. Chez les adultes, les résultats semblent les plus positifs et les plus rapides chez les patients ayant perdu récemment leur audition, ou ceux ayant eu une audition bonne ou partielle dans leur enfance, ce qui les aide à effectuer la transition et à identifier les sons perçus. Chaque cas présente ses particularités, et différentes sensations sonores temporaires peuvent être perçues juste après l'activation de l'implant : une succession de bips et sifflements sans signification, une impression de voix déformées comme celle d'un robot ou aiguës comme celle d'un personnage de dessin animé. Le niveau sonore de l'implant est lentement augmenté, pour donner le temps au cerveau de s'habituer, et il est possible dans les meilleurs cas de récupérer plus de 80 % de l'audition.[réf. souhaitée] La psychologie du patient et son vécu de sa surdité entrent pour beaucoup dans l'impression des résultats obtenus. Les adultes sourds profonds de naissance et depuis une longue durée tendent à rencontrer plus de difficultés, alors que les jeunes enfants présentent une capacité d'adaptation très élevée. Ceci peut motiver une implantation précoce chez les enfants, alors qu'une partie des sourds et mal-entendants militent pour que ces enfants puissent s'ouvrir à la langue des signes, à la culture et à la communauté sourde, et que le choix d'une implantation soit reportée à l'âge adulte.[réf. souhaitée]
En décembre 2010, environ 219 000 personnes dans le monde ont reçu des implants cochléaires ; aux États-Unis, environ 42 600 adultes et 28 400 enfants disposent d'un implant[2]. La grande majorité des personnes disposant d'un implant proviennent des pays développés, en raison du coût élevé du dispositif, de la chirurgie et du suivi. Le nombre de bénéficiaires d'un implant dans chaque oreille est restreint, mais nettement en croissance en 2007[3].
Historique
[modifier | modifier le code]
Introduction
[modifier | modifier le code]L'historique de l'implant cochléaire doit être précédé par un aperçu[4] des traitements non chirurgicaux qui, dès le XVIIIe siècle, ont été proposés pour pallier les conséquences sociétales et intellectuelles d'une surdité néonatale totale.
Leur histoire commence au début du XVIIIe siècle. Si le Français, communément nommé l’abbé de l’Épée[5] (1712-1759), n’a pas réellement inventé la langue des signes, il a en tout cas rassemblé les diverses expériences antérieures, notamment espagnoles, et il a codifié et enseigné cette technique de communication, qui facilite les contacts entre ceux qui la pratiquent, qu'ils soient ou non malentendants. Il fut en tout cas le premier à y recourir, pour faciliter le développement intellectuel et l’instruction des enfants sourds, en créant, au milieu du XVIIIe siècle, une école publique et gratuite, qui traversa la Révolution et fut pérennisée par la République naissante en Institution nationale des sourds-muets. Cet établissement, devenu Institution Nationale des Jeunes Sourds, fut toujours situé rue St Jacques à Paris. Il fut longtemps, et pour beaucoup, le phare de l’éducation des jeunes sourds, bien au-delà des frontières.
Mais pédagogues et médecins de l’Institution n’avaient pas le même regard sur les modalités d’enseignement, les premiers préférant l’oralisation (difficile, parce que dépourvue de tout feed-back sensoriel) alors que les seconds optaient pour le langage gestuel, avec Prosper Menière et Édouard Fournié. En fait, l’opposition ne concernait pas seulement la communication mais aussi la place des sourds dans la société : le langage gestuel favorisait l’instruction et l’épanouissement des sourds dans leur communauté, et l’oralisation, l’intégration des sourds dans la société des entendants.
À la fin du XIXe siècle, le développement des transports et de l'oto-rhino-laryngologie ont mondialisé cette controverse.
Les débuts de l'implant cochléaire ont été émaillés par les échecs, avec abandon de l’appareillage, rencontrés lors des tentatives d’implantation de sourds néonataux, adolescents ou adultes. Les expériences sur l’animal[6] ont permis de comprendre que les centres auditifs du tronc cérébral ne se développaient pas, s’ils n’étaient pas stimulés très tôt après la naissance. Ces échecs ont été une des causes de l’opposition de la communauté sourde à cette éventualité thérapeutique nouvelle.
La stimulation électrique des voies afférentes de l’audition n’existe que depuis la dernière moitié du XXe siècle. La description chronologique des faits conduit à distinguer trois périodes :
- recherches fondamentales et premiers essais chez l’homme (1957-1975) ;
- évolution de la technologie et des résultats de chacun des implants multi-électrodes proposés par quatre nations (France, Autriche, Australie, États-Unis) jusqu’au consensus né de cette concurrence (1976-1997) ;
- l’avènement de l’époque contemporaine.
Recherches fondamentales
[modifier | modifier le code]En 1961, Georg von Békésy (1899-1972) reçoit un Prix Nobel, pour avoir démontré que les sons entraînent une vibration de la membrane basilaire, qui se propage de la base à l’apex de la cochlée sous forme d'ondes longitudinales ; celles-ci présentent des pics en divers endroits répartis selon la fréquence, comme les touches d’un piano : les graves vers l’apex, les aiguës vers les fenêtres. On parle à ce propos de tonotopie cochléaire et le terme de « clavier cochléaire » est souvent employé.
En 1968, H. Davis codifie la physiologie des récepteurs auditifs[7]. En 1972, N. Y. Kiang décrit la physiologie de la stimulation électrique de l’oreille interne[8] et en 1975, Evans MG montre que les fibres sensorielles afférentes du nerf cochléaire ont chacune une spécificité fréquentielle, qui la rend électivement sensible à une très étroite bande de fréquences[9].
Les premiers essais chez l’humain
[modifier | modifier le code]En 1957, A. Djourno, professeur de physique médicale et C. Eyriès, otologiste parisien, redonnent, les premiers, de l'audition à un sourd total atteint de cholestéatome bilatéral, en stimulant électriquement les fibres nerveuses acoustiques encore présentes dans son oreille interne.
Certes, les résultats auditifs obtenus fortuitement par Djourno et Eyriès n'étaient pas ceux pour lesquelles ces auteurs s'étaient rassemblés transitoirement. Ils cherchaient à remobiliser les traits figés d'un patient souffrant d'un cholestéatome des deux oreilles, qui s'était compliqué, sans doute longtemps avant, d'une paralysie faciale bilatérale. Ils n'y parvinrent pas. Mais ils eurent le grand mérite de consigner en détail leurs observations électro-acoustiques, poursuivies pendant plusieurs semaines et de les publier dans la Presse Médicale[10]. On peut comprendre que ces auteurs parisiens n'aient pas repris leurs essais, lorsque leur appareil tomba en panne, après moins d'un mois.
Mais, sans eux et sans leurs réactions de chercheurs, William F. House n'aurait peut-être rien osé entreprendre pour pallier la surdité totale, dont il savait pourtant la gravité quand elle est bilatérale.
En 1961, W. House[11] était un otologiste californien, qui avait transformé le pronostic fonctionnel de la chirurgie de l'angle ponto-cérébelleux en l'effectuant à l'aide des premiers microscopes opératoires, apparus à la fin des années cinquante. Et c'est parce que cette surdité totale lui était familière, qu'un patient lui amena un jour un extrait des travaux parisiens reproduit dans le Los Angeles Times[12] : House s'empara du problème et reprit les recherches, en sélectionnant les indications en fonction de ce que l'on savait de la physiologie de l'audition, qui commençait déjà à être bien connue, au moins chez l'animal. House codifia l’intervention en positionnant l’électrode de stimulation de manière stable, en l’enfilant à travers la fenêtre ronde dans le tube cochléaire. Cet auteur connut quelques difficultés[12], notamment concernant l’étanchéité de l’implant ; elles s'aplanirent avec l'apparition des pacemakers. Cependant, il lui fallut presque dix ans pour mettre au point cet implant cochléaire monocanal. Ce système, finalement robuste et simple, stimulait l’ensemble des fibres du nerf auditif et ne permettait de reconnaître que les rythmes de la parole.
W. House commercialisa ce système avec J. Urban[13]. Il continuera à l'implanter jusqu'à au-delà de 1995. House en avait fait un système suffisamment fiable pour que les chercheurs et les otologistes ne lui reprochent plus guère que sa médiocrité fonctionnelle.
Il faut souligner ici l'influence considérable que W. House eut à cette époque sur toute une génération de jeunes chercheurs ORL du monde entier. Ceux-ci venaient à Los Angeles, soit pour y apprendre à disséquer au microscope l'ablation des tumeurs de l’angle ponto-cérébelleux, selon des méthodes chirurgicales très innovantes et simplifiées, nouvellement mises au point par W. House, soit pour parvenir à faire rapidement entendre les sourds profonds avec ce prototype d'implants cochléaires multiélectrodes, que fut pour beaucoup et pendant bien plus d'une décennie, l'implant monoélectrode et ses diverses variantes[14].
Comme un juste retour en France des travaux de Djourno et Eyriès, citons, parmi eux, les Français Jean-Marc Sterkers, qui, dès 1966, prit en charge les neurinomes[15] et divulgua en France les nouvelles méthodes chirurgicales ou, plus tard, Bernard Fraysse[16], qui, dès 1986, refit entendre de nombreux sourds avec divers systèmes mono canal. Puis, à la génération suivante, c'est Olivier Sterkers qui, inspiré par son père, utilisa, un des premiers, ses compétences neurochirurgicales pour placer les implants du tronc cérébral[17], lorsque ceux-ci furent disponibles, avant de devenir, en 2013 le Chef de l’Unité de Référence d'implantation auditive (adultes) de Paris et de la région Ile-de-France (AP-HP).
En 1966, B. Simmons[18] (Palo Alto, Californie) place le premier, chez l’homme (un volontaire sourd), un système multi-électrodes implanté temporairement dans l'épanouissement du nerf auditif lui-même. Ce travail expérimental démontre que la stimulation de contingents limités du nerf auditif entraîne des sensations fréquentiellement différentes selon l’origine cochléaire des fibres stimulées. Un peu plus tard M. Merzenich[19](UCSF-San Francisco) confirma d'une autre manière ces constations chez le macaque.
En 1967, G. Clark à Melbourne[20] constitue une équipe de recherche fondamentale sur la physiopathologie de la surdité profonde chez l’animal et la bio tolérance des matériels implantés.
R. Michelson en 1973[21](UCSF-San Francisco) place chez un homme sourd un implant multiélectrodes encore expérimental, mais chroniquement utilisable : c'est un système à quatre canaux avec quatre paires d'antennes différentes : pour chaque canal, une antenne émettrice et une antenne réceptrice. Il permettait de mesurer différents paramètres et de tester divers types de stimulation, notamment bipolaire ou monopolaire.
La même année, C.H. Chouard bénéficiait de l’amitié d’un spécialiste de la physiologie sensorielle, le Dr P. Mac Leod, et d’une expérience chirurgicale personnelle[22],[23] portant sur les nerfs vestibulaire et facial. Ils décident[24] de constituer une équipe multidisciplinaire au sein de son Laboratoire de Recherches ORL du CHU St-Antoine à Paris.
En 1975, ils démontrent, chez plusieurs patients atteints de surdité totale unilatérale traumatique avec paralysie faciale[25], que la stimulation électrique de 8 à 12 électrodes placées, isolées les unes des autres, dans différents endroits de la rampe tympanique de la cochlée, fournit des perceptions fréquentielles différentes.
Puis, après avoir mis au point un test de stimulation électrique de la fenêtre ronde destiné à être certain de la présence de fibres auditives encore fonctionnelles[26], l’équipe parisienne applique sa technique de mise en place des électrodes chez cinq patients atteints de surdité bilatérale totale ancienne. Dans les suites post-opératoires, après avoir bénéficié d’un entraînement orthophonique relativement bref, tous ces patients ont pu reconnaître un pourcentage variable de mots sans lecture labiale[27]. Sous la direction scientifique de P.Mac Leod, la fabrication industrielle d’un système implantable fonctionnel est alors confié à la Société Bertin©. L’appareil de table fut vite construit ; mais la mort prématurée de Jean Bertin à la fin de 1975 entraîna une restructuration de la Société, obligeant les Français à attendre l'été 1976 pour recevoir enfin les six premiers appareils.
D’autres équipes en France entamèrent également leurs propres recherches, notamment dans le domaine du porte-électrodes, mais elles ne purent se poursuivre[28],[29],[30].
En 1975, K. Burian[31], à Vienne, poursuivant la longue tradition de l'école ORL viennoise, évoque la problématique du premier implant autrichien.Ses travaux, qui ont exploré la stimulation monocanal intra et extra cochléaire, puis la stimulation multiélectrodes, seront ensuite repris peu après par son élève I. Hochmair-Desoyer et l’époux de celle-ci le Pr Hochmair de Innsbrück, pour aboutir, à partir de 1982, à l'implant autrichien Med-El.
Évolution
[modifier | modifier le code]Cette section traite de l'évolution de la technologie et des résultats des implants proposés par quatre nations (France, Autriche, Australie, États-Unis) jusqu’au consensus né de cette concurrence (1976-1997).
La première implantation eut lieu à Saint-Antoine le mercredi . Elle fut réalisée par C.H. Chouard assisté de Bernard Meyer. Devant l’audition revenue dès le lendemain, malgré le volume incommode de l’émetteur, les cinq autres patients furent très vite opérés. La société Bertin dépose le le brevet no 77/07824. Ce brevet, issu des exigences physiologiques de Mac Leod, comportait deux revendications simultanées :
- la transmission séquentielle à la cochlée d’un nombre indéterminé de bandes de fréquence ;
- la transmission de la totalité de l'information sonore audible.
Les premiers résultats furent présentés le lendemain au XIth World Congress of O.R.L. , qui se tenait alors à Buenos-Aires, puis rapidement publiés[32],[33].
Pendant près de vingt ans, ce document[34] va conditionner toutes les procédures et les recherches utilisées par les autres équipes internationales, qui seront obligées de le contourner, le plus souvent en n'envoyant qu'une partie de l'information sonore de la parole, jusqu'à ce que ce brevet tombe dans le domaine public en 1997.
Le , l’équipe de l'Australien G. Clark dépose le brevet d’un système comportant trois électrodes fonctionnelles et n’utilisant qu’une partie limitée de l’information sonore de la parole (voisement et un des deux formant des voyelles). En l’équipe autrichienne, après avoir employé une stimulation monocanal, implante un système multicanaux dont la souplesse le rend capable d’étudier les réponses à des traitements du signal sonore différents[35].
En a lieu à Paris le 1er cours international sur l’implant cochléaire, auquel assistent les représentants[36] des trois autres nations impliquées I. Hochmair-Desoyer et E . Hochmair (Autriche), J. Patrick (Australie), R. Michelson et R. Schindler (USA). G. Clark (Australie) implante son premier patient[37].
En 1982, Chouard, utilisant la technique de reconstruction de Born, qu’il avait employée dans ses recherches neuro-anatomiques effectuées avec C. Eyriès[38], démontre le premier, chez l’animal[6], la nécessité d’une implantation la plus précoce possible, pour éviter l’atrophie des formations auditives centrales qui se produit très vite en cas de surdité néo-natale persistante.
Le nouvel appareil de Bertin est présenté : le Chorimac 12 a maintenant douze électrodes et son émetteur est plus petit, mais il est encore beaucoup plus gros que les appareils australiens et autrichiens. Quelques années plus tard après avoir annoncé l’arrivée de l’appareil entièrement numérique[39] que Chouard et Mac Leod réclamaient depuis 1980, Bertin abandonne l’implant et en vend en 1987 la licence à une société française : MXM-Neurelec. Bertin est mis en faillite en 1998.
En 1982, lors d’un Symposium organisé par l'Académie des Sciences de New York, pour faire le point sur l’implant cochléaire[40], l'équipe parisienne a pu présenter ses résultats obtenus chez ses 48 premiers patients, dont 45 portaient leur appareillage depuis plus d'un an. Ces auteurs détaillaient également de nombreuses innovations, l’électrodogramme notamment, qui facilitait l'adaptation de l’implant à la quantité des fibres nerveuses restantes de chaque patient, et à leur situation sur le clavier cochléaire. Ces procédures facilitaient la rééducation. Elles ont été adoptées plus tard par la plupart des équipes internationales. Les résultats français obtenus en 1982 étaient considérables au regard de ceux des autres équipes présentés lors de cette Conférence : le nombre de ces autres patients implantés avec un système multiélectrode était au total inférieur à une dizaine.
En 1983, se tient à Paris, dans l’ancienne faculté de médecine, le 2e congrès international sur l’implant cochléaire, juste avant la réunion dans les mêmes locaux du meeting annuel du Collegium international d'ORL (Collegium ORLAS).
L'US Food and Drug Administration approuve en 1984 l’implant australien dans ses indications pour l’adulte. En 1985, les Australiens améliorent[41] leur appareil initial, qui transmet maintenant la totalité de l’information concernant les voyelles[42].
En 1988, l'Américain B. Wilson propose un système[43] directement inspiré du brevet français, auquel il ne fera jamais fait référence dans aucune de ses publications qui suivront. Il y adjoint une modification concernant le rythme de la stimulation, qu’il nomme Continuous Inerleaved Stimulation (CIS). Mais, les descriptions qu’il en fit ensuite, notamment en 1991 dans Nature[44], puis lors d’un événement médiatique récent[45] pour surprenantes qu’elles aient été sur le plan de l’électrophysiologie du nerf cochléaire, n’ont curieusement jamais été discutées jusqu’à la parution fin 2014 de trois articles techniques rectificatifs[46],[47],[48].
En 1990, l’US Food and Drug Administration approuve l’implant australien dans ses indications pour le jeune enfant. En 1991 MXM-Neurelec présente leur premier implant multi-électrodes construit à partir de la licence Bertin. Il est entièrement numérisé et peut être adapté aux cochlées ossifiées[49].
À partir de 1992, l’implant cochléaire multi-électrodes est à peu près admis en France. D’autres équipes, les deux premières à Montpellier[50] et à Toulouse[51], commencent à le mettre en place.
Simultanément, les différents implants cochléaires modifient progressivement leur stratégie du traitement du signal sonore. Celle-ci se rapproche de plus en plus de la technologie du brevet Bertin, c'est-à-dire envoyer aux patients la totalité de l'information de manière séquentielle. L’implant américain envoyait lui aussi de cette façon la totalité de l'information, mais quelques artifices habillement trouvés et quelques restrictions évitaient à ses promoteurs de tomber dans le domaine du brevet français. L'appareil australien modifia sa stratégie à son tour, en envoyant également la totalité de l’information sonore, mais en ne retenant que les canaux dans lesquels se trouvait le maximum d’énergie. Cette restriction, là encore permit à ce constructeur de ne rien redouter des détenteurs du brevet Bertin[52].
En 1995, Paris organise le 3e congrès international sur l'implant cochléaire. En 1997, la licence française fut indubitablement copiée. La Société Bertin intenta alors un procès en bonne et due forme, avec saisie du matériel et constats d'huissiers. C’était d’ailleurs juste avant que le brevet ne tombe dans le domaine public. Mais, après quelques tapages et quelques émotions dans certains centres chirurgicaux, les poursuites ont été vite abandonnées : le coût des procédures et des expertises à venir dépassait de beaucoup les avantages financiers que l'entreprise pouvait en attendre.
Depuis, tous les constructeurs appliquent les principes du brevet Bertin, définis par P. Mac Leod et CH Chouard[53].
Années 2000
[modifier | modifier le code]À la suite de l’Avis du Comité Consultatif National d’Éthique[54] concernant le dépistage de la surdité dans la période néonatale précoce[55] et depuis le tricentenaire des travaux de l'abbé de l'Épée[56] célébré en 2012, se dessine en France un rapprochement entre les deux communautés sourdes et non sourdes. Dans un dialogue commun, dont la cordialité et le respect de l'autre restent les grands principes[57], les deux cultures, évitant tout prosélytisme, s’efforcent d’éclairer au mieux les enjeux du choix, pas toujours exclusif dans certaines indications, entre l’implant cochléaire et la langue des signes.
Composition de l'implant
[modifier | modifier le code]

L'implant est placé chirurgicalement sous la peau, derrière l'oreille. Il existe plusieurs fabricants et différents modèles, mais ils se composent tous d'une partie externe et d'une partie interne.
La partie externe comporte :
- un ou plusieurs microphones qui captent l'environnement sonore et transforment le son en signal électrique;
- un processeur qui filtre les informations sonores reçues, afin notamment de traiter en priorité la voix humaine, et les répartir sur différents canaux. Les impulsions électriques sont dirigées ensuite vers le transmetteur à travers un fin fil conducteur;
- un transmetteur par induction électromagnétique, maintenu par un aimant placé derrière l'oreille externe. Le transmetteur fournit à la partie interne de l'appareil l'énergie nécessaire au fonctionnement de l'appareil ainsi que les signaux électriques traités par le processeur.
La partie interne se compose de :
- un récepteur et stimulateur, placé sous la peau, il est relié à l'os afin d'être maintenu en place. Il convertit les signaux sous formes d'impulsions électriques et les envoie à travers un câble jusqu'aux électrodes;
- un groupe d'électrodes pouvant aller jusqu'à 22 électrodes pour les modèles les plus récents, traversent la cochlée et transmettent les impulsions électriques aux nerfs de la rampe tympanique qui les relaient jusqu'au cerveau.
Fonctionnement
[modifier | modifier le code]Les informations sonores reçues par un appareil installé derrière le pavillon (oreille externe), sont traitées par un microprocesseur inclus dans cet appareil. Le signal électrique est envoyé vers la cochlée, par un fil reliant une antenne (posée sous la peau du sujet) qui transmet le signal aux électrodes implantées dans la cochlée (jusqu'à 22 électrodes).
Les sensations sonores perçues par le sujet peuvent au début ne pas correspondre aux sensations de l'audition normale, ni à celles de l'audition appareillée de façon externe. C'est la raison pour laquelle une éducation auditive spécifique pratiquée avec un audiologiste ou un orthophoniste (professionnel qui traite et rééduque les troubles de communication liés à l'audition) est presque toujours nécessaire à sa bonne intégration par le sujet qui la porte.
Après une période d'adaptation, les résultats deviennent très souvent excellents : de très nombreux adultes devenus sourds ou enfants implantés très précocement sont par exemple capables d'utiliser le téléphone. Les publications récentes indiquent qu'approximativement un tiers des enfants implantés obtient d'excellents résultats avec une compréhension équivalente à celle d'enfants normo-entendants, qu'un autre tiers acquiert une compréhension de la parole correcte, et que le dernier tiers rencontre des difficultés (très souvent corrélées avec une implantation tardive ou la présence d'autres troubles que la surdité)[58].
Coût
[modifier | modifier le code]En 2004 en France, le coût de l'implantation[59] est compris entre 34 000 € (enfants) et 32 000 € (adultes), l'implant cochléaire coûtant 22 000 €, l'opération 2000 à 3 000 € et la réhabilitation 4000 à 6 000 €. Toutefois, selon la même source, les chiffres de prise en charge totaux dans différents pays vont de 25 000 € à 64 000 € (valeur 2001).
Les différentes études coûts/utilité (QALY) de l'opération de pose d'implants cochléaire sont toutes positives, même chez les patients âgés jusqu'à 82 ans[60]. Pour les enfants, les économies réalisées par la suite sur le coût de l'enseignement compensent à eux seuls un quart des coûts d'implantation.
Les fabricants d'implants cochléaires reconnus en France sont Advanced bionics SARL, Cochlear France SARL, Neurelec, Vibrant MED-EL Hearing technology[61].
Implantation
[modifier | modifier le code]Elle se fait sous anesthésie générale et l'opération pour une oreille dure trois heures environ. Les électrodes cochléaires sont glissées dans cette dernière après création d'une minime ouverture dans l'os mastoïde, derrière l'oreille.
Des complications sont possibles mais le plus souvent mineures[62]. À long terme, le taux de pannes nécessitant une réintervention peut atteindre 3 à 6 % des cas[63].
L'implant n'est pas adapté à tous les cas de surdité.
Questions éthiques
[modifier | modifier le code]La surdité peut s'atténuer naturellement (mais les cellules auditives ne se régénèrent pas), le cerveau palliant la déficience auditive principalement par la suppléance mentale. Avec des efforts suivis, et des appareils amplificateurs amovibles adaptés, même des petits enfants sourds arrivent à parler et à chanter des comptines, sauf pour les surdités profondes. L'implantation sur les jeunes enfants constitue pour les parents une décision difficile à prendre.
La politique actuelle d’implantation d’enfants sourds pré-linguaux est vivement contestée par une partie de la communauté sourde[64]. En effet, elle y voit une dévalorisation de la langue des signes au profit de la langue orale, voire une négation de la culture sourde. Une partie de la communauté sourde interprète le choix des parents d’enfants sourds qui optent pour l’implantation de leur bébé, comme une tentative de « réparer la surdité », de « réparer leur enfant », en en faisant un mauvais entendant, un malentendant, handicapé à la fois dans le monde sourd et dans le monde entendant. Elle craint que le choix de faire opérer un enfant sourd risque de freiner son intégration dans la communauté sourde sans pour autant lui assurer une intégration parfaite dans la communauté entendante.
Cette position est vivement défendue par la communauté sourde signante mais ne reflète aucunement la position de la Haute Autorité de Santé.
En France, le comité consultatif national d'éthique estime que, si les parents optent pour une implantation cochléaire, il convient de conjuguer l’implantation à un apprentissage de la langue des signes dès que possible, soit vers l'âge d'un an[65].
En revanche, l'avis[66] (plus récent) de la Haute Autorité de Santé conseille d'implanter l'enfant sourd profond le plus précocement possible pour lui permettre d'entrer le plus facilement possible dans l'oralité. Aucune mention n'est faite de la Langue des Signes.
Notes et références
[modifier | modifier le code]- « Qu'est-ce qu'un Implant Cochléaire ? », sur advancedbionics.com (consulté le )
- (en) NIH Publication No. 11-4798, « Cochlear Implants », National Institute on Deafness and Other Communication Disorders, : « as of December 2010, approximately 219,000 people worldwide have received implants. In the United States, roughly 42,600 adults and 28,400 children have received them. »
- (en) Nabila Ahmed, « Cochlear heads for earnings record », The Age, (lire en ligne, consulté le )
- « Medic@ », sur univ-paris5.fr via Wikiwix (consulté le ).
- « Les soins médicaux aux sourds-muets en France au XIXe siècle », sur univ-paris5.fr via Internet Archive (consulté le ).
- (en) Effect of chronic electric stimulation of the auditory nerve on the development of the cochlear nuclei in guinea pigs. Chouard CH, Josset P, Meyer B, Buche JF. Ann Otolaryngol Chir Cervicofac. 1983;100(6):417-22. French. indexed for Medline
- (en) H. Davis. « Excitation of auditory receptors » In Handbook of physiology, Section 1 – Neurophysiology vol.1 1968. Ifield, HW Makgrun and VE Hall Ed.
- (en) Kiang NY. et Moxon EC. « Physiological considérations in artificial stimulation of the inner ear » Ann Otol Rhinol Laryngol. 1972;81:714-30.
- (en) Evans EF. (1975). « The sharpening of cochlear frequency selectivity in the normal and abnormal cochlea » Audiology 1975;14(5-6):419-42.
- (en) Djourno A, Eyriès C. « [Auditory prosthesis by means of a distant electrical stimulation of the sensory nerve with the use of an indwelt coiling] » Presse Med. 1957;65(63):1417.
- (en) House WF, House HP, Urban J. « Operating microscope observation viewer and motion picture camera » Trans Am Acad Ophthalmol Otolaryngol. 1959;63(2):228-9.
- (en) Eshraghi AA, Nazarian R, Telischi FF, Rajguru SM, Truy E, Gupta C. « The cochlear implant: historical aspects and future prospects » Anat Rec (Hoboken) 2012;295(11):1967-80.
- (en) House WF, Urban J. « Long term results of electrode implantation and electronic stimulation of the cochlea in man » Ann Otol Rhinol Laryngol. 1973;82(4):504-17.
- Chouard C-H. Histoire de l’implant cochléaire. Annales françaises d’oto-rhino-laryngologie et de pathologie cervico-faciale (2010) 127, 288—296.
- Sterkers JM. Une nouvelle application de la microchirurgie : le vertige de Meniere et le neurinome de l’acoustique. Cah Coll Med Hop Paris. 1966 Dec 15;7(11):715-20.
- Fraysse B, Soulier MJ, Urgell H, Levy P, Furia F, Defrennes V. Extracochlear implantation : technique and and results. Annals of Otology, Rhinology & Laryngology, jan 1987 ; 96, Suppl 128, 111-113.
- (en) Wu H, Kalamarides M, Bouccara D, Dahan EA, Viala P, Sollmann WP, Rey A, Sterkers O. Auditory brainstem implant (Nucleus 21-channel) in neurofibromatosis type 2 patients previously operated on: preliminary results. Adv Otorhinolaryngol. 2000;57:236-9.
- (en) Simmons FB. « Electrical stimulation of the auditory nerve in man » Arch Otolaryngol. 1966 Jul;84(1):2-54.
- (en) Merzenich MM, Brugge JF. « Representation of the cochlear partition of the superior temporal plane of the macaque monkey » Brain Res. 1973;50(2):275-96.
- [PDF] http://www.nature.com/focus/Lasker/2013/pdf/ES-Lasker13-Clark.pdf
- (en) Sooy F. and Michelson R.P. : An electrical cochlear prosthesis for profound sensory deafness. Clinical results. X World Congress of O.R.L. , Venise, mai 73, Excerpta Medica Edit., Amsterdam, no 276, p. 1.
- (en) Indications of nerve decompression in facial paralysis a frigore Chouard C.H., Cathala H.P., Presse Med. 1969 Oct 11;77(42):1471-4.
- Surgical treatment of vertigo by vestibular neurectomy. Principle and technic. Chouard C.H., Rev Laryngol Otol Rhinol (Bord). 1973 jan-feb ;94(1):51-8.
- Letter: Rehabilitation of total deafness. Trial of cochlear implantation with multiple electrodes. Chouard CH, Mac Leod P. Nouv Presse Med. 1973 Dec 8;2(44):2958.
- Physiological assessment of the rehabilitation of total deafness by the implantation of multiple intracochlear electrodes. Mac Leold P, Pialoux P, Chouard CH, Meyer B. Ann Otolaryngol Chir Cervicofac. 1975 jan-feb;92(1-2):17-23.
- (en) Chouard CH, Meyer B, Donnadieu F. Auditory Brain Stem in man evoked by electrical stimulation of the round window. Acta Otolaryngol. (Stockholm). mars 1979; 87 : 287-293.
- Chouard CH, Mac Leod P. Implantation of multiple intra-cochlear electrodes from rehabilitation of total deafness: Preliminary report. Laryngoscope 1976 ; 86: 1743-1751.
- Chouard CH, Pialoux P, Mac Leod P, Charachon R, Meyer B, Soudant J., Morgon A. Stimulation électrique du nerf cochléaire chez l’homme. XIIe Congrès International d’Audiologie, Paris 1974.
- Accoyer B, Charachon R, Richard J. Electrocochlearography. First clinical results. JF Otorhinolaryngol. Audiophonol. Chir Maxillofac, juin 1974 ; 23(6): 499-505.
- Accoyer B. Approche théorique et clinique du traitement des surdités totales par implantations chroniques d’électrodes intra-cochléaire multiples ; Thèse de médecine, Grenoble, janvier 1976, 184 pages.
- (en) Letter: Significance of cochlear nerve electric stimulation in totally deaf patients Burian K. Laryngol Rhinol Otol (Stuttg). juin 1975 ;54(6):530-1.
- (en) Chouard CH, Mac Leod P, Meyer B, Pialoux P. « Surgically implanted electronic apparatus for the rehabilitation of total deafness and deaf-mutism » Ann Otolaryngol Chir Cervicofac. 1977 Jul-Aug;94(7-8):353-63.
- (en) Pialoux P, Chouard CH, Meyer B, Fugain C. « Indications and results of the multichannel cochlear implant » Acta Otolaryngol. 1979 Mar-Apr;87(3-4):185-9.
- « Brevet du développement technique de l'implant »
- (en) Hochmair ES, Hochmair-Desoyer IJ, Burian K. « Investigations towards an artificial cochlea » Int J Artif Organs. Septembre 1979 ;2(5):255-61.
- « Meeting des Principaux représentants de l'implant cochléaire »
- Tong YC, Black RC, Clark GM, Millar JB, O'Loughlin BJ, Patrick JF. A preliminary report on a multiple-channel cochlear implant operation. J Laryngol Otol. 1979 Jul; 93(7): 679-95.
- Acoustico-facial anastomoses Eyries C, Chouard CH.Ann Otolaryngol Chir Cervicofac. 1970 Jun;87(6):321-6. French. No abstract available. [PubMed - indexed for Medline]
- MINIMAC: a totally numeric 15 channel implanted stimulator Chouard CH, Weber JL. Pacing Clin Electrophysiol. Avril 1989 ;12(4 Pt 2):743-8
- « Chouard CH. The early days of the multi channel cochlear implant: Efforts and achievement in France. 2014. Hear Res. 2014 Dec 10.. doi: 10.1016/j.heares.2014.11.007 »
- (en) Tye-Murray N, Lowder M, Tyler RS « Comparison of the F0F2 and F0F1F2 processing strategies for the Cochlear Corporation cochlear implant » Ear Hear. 1990 Jun;11(3):195-200.
- (en) Blamey PJ, Martin LF, Clark GM. « A comparison of three speech coding strategies using an acoustic model of a cochlear implant » J Acoust Soc Am. 1985 Jan;77(1):209-17.
- (en) Wilson BS, Finley CC, Farmer JC Jr, Lawson DT, Weber BA, Wolford RD, Kenan PD, White MW, Merzenich MM, Schindler RA. « Comparative studies of speech processing strategies for cochlear implants » Laryngoscope. 1988 Oct;98(10):1069-77.
- (en) Wilson BS, Finley CC, Lawson DT, Wolford RD, Eddington DK, Rabinowitz WM. « Better speech recognition with cochlear implants » Nature. 1991 Jul 18;352(6332):236-8.
- http://www.laskerfoundation.org/awards/pdf/2013_c_wilson.pdf « Copie archivée » (version du sur Internet Archive)
- (en) Chouard, C.H. « The 2013 Lasker-DeBakey Clinical Medicine Research Award and cochlear implants: France unjustly overlooked…! » Eur Ann Otorhinolaryngol Head Neck Dis. 2014;131(2):79-80. DOI 10.1016/j.anorl.2014.01.002
- (en) Chouard, C.H. « Technical survey of the French role in multichannel cochlear implant development ». 2014. Acta Otolaryngol. 2014;10:1-9.
- (en) Chouard, C.H. « The early days of the multi channel cochlear implant: Efforts and achievement in France » Hear Res. 2014. DOI 10.1016/j.heares.2014.11.007
- Clinical results for the Digitonic multichannel cochlear implant Chouard CH, Meyer B, Fugain C, Koca O. Laryngoscope. Mai 1995 ;105(5 Pt 1):505-9.
- (en) Multichannel cochlear implantation in prelingually and postlingually deaf children Uziel AS, Reuillard-Artières F, Mondain M, Piron JP, Sillon M, Vieu A. Adv Otorhinolaryngol. 1993;48:187-90.
- Speech perception performance in prelingually deafened children with the nucleus multichannel cochlear implant Uziel AS, Reuillard-Artieres F, Sillon M, Vieu A, Mondain M, Fraysse B, Deguine O, Cochard N. Adv Otorhinolaryngol. 1995;50:114-8.
- « History of the french cochlear implant », sur online.fr (consulté le ).
- (en) Chouard Ch. The early days of the multi channel cochlear implant: Efforts and achievement in France. 2014. Hear Res. 2014 Dec 10.. doi: 10.1016/j.heares.2014.11.007
- Avis no 103. Éthique et surdité de l’enfant : éléments de réflexions à propos de l’information sur le dépistage précoce de la surdité dans les maternités
- Legent F. Bull. Acad. Natle Méd., 2008, 192, no 6, 1233-1235
- « Tricentenaire de l’Abbé de l’Épée (1712-1789) - », sur Le blog actualités de la BIU Santé, (consulté le ).
- L’enfant sourd profond. Morgon A. Bull. Acad. Natle Méd., 2006, 190, no 8, 1653-1662
- Uziel AS, Sillon M, Vieu A, et als. Ten-year follow-up of a consecutive series of children with multichannel cochlear implants, Otol Neurotol 2007;28:615-628
- Haute autorité de santé, 2007 Traitement de la surdité par la pose d'implant cochléaires ou d'implants du tronc cérébral, mai 2007, tableau 9, p. 54, données statistiques basée sur 89 % des opérations pratiquées entre 2002 et 2004
- Haute autorité de santé, 2007 Traitement de la surdité par la pose d'implant cochléaires ou d'implants du tronc cérébral, mai 2007, p. 55-57
- Haute autorité de santé, 2007 Traitement de la surdité par la pose d'implants cochléaires ou d'implants du tronc cérébral, mai 2007, p. 7
- (en) Bhatia K, Gibbin KP, Nikolopolous TP, O'Donoghue GM, Surgical complications and their management in a series of 300 consecutive pediatric cochlear implantations, Otol Neurotol 2004;25:730-739
- Côté M, Ferron P, Bergeron F, Bussières R, Cochlear reimplantation: causes of failure, outcomes, and audiologic performance, Laryngoscope, 2007;117:1225-1235
- (en) Balkany TJ, Hodges AV, Goodman KW. Ethics of cochlear implantation in young children, Otolaryngol Head Neck Surg 1996;114:748-755
- Avis no 44 rendu le 1er décembre 1994 par le CCNE
- http://www.has-sante.fr/portail/upload/docs/application/pdf/fiche_bon_usage_implants_cochleaires.pdf
Voir aussi
[modifier | modifier le code]Articles connexes
[modifier | modifier le code]- Surdité
- Audioprothèse
- Langue des signes
- Histoire des sourds
- Histoire de la langue des signes
- Langage parlé complété
Bibliographie
[modifier | modifier le code]- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Cochlear implant » (voir la liste des auteurs).
- (en) Richard T. Miyamoto (dir.), Cochlear Implants : proceedings of the VIII International Cochlear Implant Conference held in Indianapolis, Indiana, USA between 10 and 13 may 2004, Elsevier, Amsterdam, 2004, 478 p. (ISBN 0-444-51848-7)
- Audrey Colleau (dir.), Implantations cochléaires, Fédération nationale des orthophonistes, Paris, 2004, 186 p. (numéro de Rééducation orthophonique, 42e année, 2004 no 217)
- Jean Giot et Laurence Meurant (dir.), Éthique et implant cochléaire : que faut-il réparer ?, Presses universitaires de Namur, Namur, 2006, 90 p. (ISBN 978-2-87037-530-3)
Filmographie
[modifier | modifier le code]- Eulalie, la belle parole, film documentaire de Murielle Schulze
Liens externes
[modifier | modifier le code]- Implant cochléaire chez l'enfant et l'adulte expliqué sur le site de l'hôpital de Marseille
- L'implant cochléaire, par le centre d'information sur la surdité et l'implant cochléaire
- Publications historique sur l'implant cochléaire
- Association des Implantés Cochléaire du Québec (AICQ)
- Qu'est-ce qu'un Implant Cochléaire, schéma explicatif
