Macromycète
Les expressions « Macromycètes » et « Macrochampignons » désignent en français plusieurs taxons distincts.
Taxons concernés
Environ 5 % du règne des Fungi :
- Division des Basidiomycota
- Agaricomycotina (principalement) ;
- (Ustilaginomycotina) ;
- Pucciniomycotina ;
- Division des Ascomycota
- Pezizomycotina (principalement) ;
- Taphrinomycotina (genre Neolecta) ;
- Division des Mucoromycota
- ordre des Endogonales ;
- Division des Glomeromycota
- genre Glomus (quelques espèces) ;
- Division des Mortierellomycota
- genre Modicella (2 espèces).
Les macromycètes ou macrochampignons sont des champignons dont la fructification (le sporophore) est visible à l'œil nu. Ils s'opposent en cela aux micromycètes ou microchampignons qui ne peuvent être observés qu'au microscope, comme les levures ou les moisissures. Il s'agit d'une notion vague, aux limites peu claires, et qui ne recouvre aucune réalité évolutive ou taxinomique tangible. Elle est souvent utilisée pour désigner de manière savante les « champignons » de la langue courante, c'est-à-dire ceux susceptibles d'être récoltés pour l'alimentation ou d'autres usages.
Alors que l'appareil végétatif des macromycètes (le mycélium) a une organisation assez simple, leur organe de reproduction (le sporophore) est une structure multicellulaire complexe, comparable à celles produites par la plupart des animaux et des plantes terrestres. Moins de 10 % des espèces du règne des Fungi ont développé cette capacité. Elle leur vaut la dénomination de champignons supérieurs, appliquée classiquement aux branches les plus « évoluées » des divisions Basidiomycota et Ascomycota. Les analyses moléculaires du XXIe siècle tendent cependant à contredire cette approche linéaire et ont découvert entre 8 et 12 origines indépendantes de multicellularité complexe chez les champignons. Plusieurs lignées ont par ailleurs perdu leur capacité à former des sporophores macroscopiques au cours de l'évolution.
Malgré ces réserves, la notion de macrochampignon reste utile à des fins descriptives dans plusieurs domaines. La cueillette et la culture de macromycètes pour l'alimentation humaine ou la médecine traditionnelle sont des secteurs sociologiques, culturels et économiques à parts entières. Les intoxications aux macromycètes constituent un champ d'étude différencié de la mycologie médicale. Les efforts de conservation de la nature se concentrent principalement sur la fonge macroscopique, et les listes rouges nationales et internationales ne comprennent que des macromycètes et des lichens. Enfin, puisqu'ils constituent la partie la plus visible du règne fongique, les macromycètes ont une place importante dans l'imaginaire collectif, la symbologie et la production artistique de nombreuses sociétés humaines.
Définitions
[modifier | modifier le code]Pour la plupart des glossaires, un macromycète est simplement un champignon de grande taille[1], dont on précise souvent qu'il est visible à l'œil nu[2]. Cette définition ne fait pas allusion à l'organe végétatif et souvent souterrain du champignon (le mycélium), mais à son appareil reproducteur, le sporophore. Bien que massif, ce dernier n'est formé que de filaments, appelés hyphes, et dont chacun est de l'épaisseur d'une file de cellules. C'est donc à l'accolement des hyphes (microscopiques) que l'appareil reproducteur des champignons dits « supérieurs » doit d'être plus ou moins charnu[3].
De manière informelle, le terme « macromycète » est utilisé pour faire allusion aux champignons comestibles, toxiques ou utiles, susceptibles d'être récoltés, comme l'agaric, le cèpe, le polypore, la morille, etc.[4], ce qui exclut non seulement les levures et les moisissures, mais aussi les champignons responsables de maladies cryptogamiques comme les rouilles ou les charbons[5]. Enfin, bien que formant des structures macroscopiques, les lichens qui résultent de l'association symbiotique entre une algue et un champignon font habituellement l'objet d'une littérature et de recherches séparées[6].
Phylogénie et histoire évolutive
[modifier | modifier le code]Multicellularité complexe chez les champignons
[modifier | modifier le code]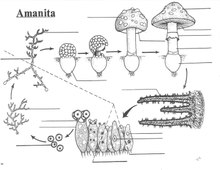
Chez les organismes vivants, la multicellularité se présente sous de nombreuses formes et niveaux de complexité. Les simples agrégations cellulaires et la formation de colonies sont apparues au moins 25 fois dans l'évolution, autant chez les procaryotes que chez les eucaryotes. En revanche, la multicellularité complexe, c'est-à-dire le développement de structures tridimensionnelles différenciées, n'est observée que dans cinq groupes : les animaux, les plantes terrestres, les algues rouges, les algues brunes et les champignons[7].
Chez les champignons, la multicellularité est apparue sous forme de thalles composés d'hyphes, qui ont probablement évolué pour optimiser l'efficacité de la recherche de nourriture. Ces structures montrent cependant une croissance indéterminée et la différenciation cellulaire y est limitée. De plus, toutes les cellules sont en contact direct avec l'environnement extérieur, ce qui signifie que l'absorption de nutriments et d'oxygène n'est pas entravée par une organisation compacte en trois dimensions. Les mycéliums végétatifs des champignons sont ainsi considérés comme un niveau simple de multicellularité[8].
À l'inverse, les appareils reproducteurs (sporophores) développés par certaines lignées montrent une organisation différenciée et tridimensionnelle, avec un programme de développement intégré spatialement et temporellement : ces structures grandissent jusqu'à atteindre une forme et une taille génétiquement prédéterminées. La multicellularité complexe chez les champignons a donc principalement un rôle dans la reproduction, alors que la multicellularité simple est utilisée pour la recherche de nutriments et l'exploration du substrat. Les macromycètes alternent entre ces deux niveaux de complexité au cours de leur cycle de vie, ce qui les distingue de tous les autres organismes pluricellulaires[8].
Distribution phylogénétique
[modifier | modifier le code]L'immense majorité des champignons formant des sporophores multicellulaires se retrouvent parmi les Basidiomycètes et les Ascomycètes. Ces deux divisions le plus « évoluées » du règne des Fungi ont récemment été réunies dans le sous-règne des Dikarya, ou champignons « dicaryotiques »[9]. Mais des structures multicellulaires complexes se produisent également, quoique de façon beaucoup plus modeste, chez certaines lignées plus primitives. Les études phylogénétiques ont mis en évidence pas moins de 8 clades au sein desquels ce trait a évolué de manière indépendante. Chacun de ces groupes comprend en outre des espèces qui ne forment pas de fructifications, et cette capacité a peut-être été développée par plusieurs lignées distinctes au sein d'un même groupe. Chez les champignons, la multicellularité complexe pourrait ainsi avoir jusqu'à 12 origines différentes[8].
| Sous-règne | Division | Sous-division | Nombre d'espèces | Exemples | |
|---|---|---|---|---|---|
| Dikarya | Basidiomycota | Agaricomycotina | >20 000 |  |
Amanita muscaria |
 |
Trametes versicolor | ||||
| Ustilaginomycotina | 1 700[a] |  |
Exobasidium rhododendri | ||
| Pucciniomycotina | 8 400 |  |
Gymnosporangium clavariiforme | ||
| Ascomycota | Pezizomycotina | >32 000 |  |
Gyromitra esculenta | |
 |
Aleuria aurantia | ||||
| Taphrinomycotina | 3 |  |
Neolecta irregularis | ||
| Mucoromyceta | Mucoromycota | Mucoromycotina | 25 |  |
Endogone pisiformis |
| Glomeromycota | Glomeromycotina | 1 à 10 |  |
Glomus spp. | |
| Mortierellomycota | Mortierellomycotina | 2 |  |
Modicella spp. | |
Basidiomycètes
[modifier | modifier le code]Les Basidiomycètes tirent leur nom de cellules spécialisées, appelées basides, et responsables de la production des spores. La sous-division des Agaricomycotina inclut les macromycètes les plus connus : amanites, bolets, polypores, vesses-de-loup, etc. La plupart des espèces produisent des fructifications pourvues d'un hyménium dont la configuration (en lames, en tubes, en aiguillons, etc.) a longtemps servi à classer les différents groupes. Ils sont désormais divisés en trois classes et comprennent plus de 1 000 genres et au moins 21 000 espèces[10]. Presque toutes produisent des sporophores, à l'exception de quelques lignées de Tremellomycetes qui ont regressé en levures (comme Cryptococcus neoformans)[11] et de certaines Pterulaceae associées aux fourmis champignonnistes[12],[13].
Les deux autres sous-divisions de Basidiomycètes regroupent des champignons parasites des plantes : les charbons (Ustilaginomycotina) et les rouilles (Pucciniomycotina)[10]. La plupart des espèces ont des structures unicellulaires de type levure ou multicellulaires simples. Quatre classes de Pucciniomycotina sont néanmoins connues pour former des sporophores : Atractelliomycetes, Agaricostilbomycetes, Pucciniomycetes et Microbotryomycetes. Ils présentent des morphologies en baguettes de tambour (Phleogena), en coupes (Kriegeria), en croûtes (Septobasidium) ou en gelées (Helicogloea). La phylogénie de ces groupes étant toujours débattue, il existe une certaine incertitude quant au nombre d'origines indépendantes de ces développements évolutifs[8].
La présence de véritables sporophores chez les Ustilaginomycotina est en revanche controversée. Certaines espèces (par exemple Testicularia spp., Exobasidium spp.) produisent des sortes de galles sur les plantes parasitées qui sont principalement constituées d'hyphes fongiques, mais qui incorporent également du tissu végétal[8].
Ascomycètes
[modifier | modifier le code]Les Ascomycètes représentent à eux seuls plus de 65 % de la diversité fongique. Ils se distinguent par une structure de reproduction sexuée en forme de sac nommée asque. Cette division comprend principalement des champignons microscopiques, notamment des levures, mais aussi quelques macromycètes bien connus des gastronomes, comme les morilles et les truffes (classe des Pezizomycetes). Il faut également noter la présence parmi les Ascomycètes du genre Neolecta, un fossile vivant qui forme des sporophores à hyménium, mais n'a aucun parent proche[14].
Mucoromycètes
[modifier | modifier le code]Les Mucoromycètes comprennent principalement des moisissures multicellulaires simples, mais aussi trois petits groupes formant des fructifications macroscopiques. Les membres de l'ordre des Endogonales forment des sporophores globuleux ressemblant à des truffes et remplis de zygospores[8]. Certaines espèces de Glomeromycètes produisent également des fructifications souterraines. Enfin, le genre Modicella comprend deux espèces qui ont développé indépendamment la capacité de produire de petits sporophores pédonculés[15].
Hypothèses évolutives
[modifier | modifier le code]Diversité et distribution
[modifier | modifier le code]
Le chiffre de 140 000 espèces de macromycètes, estimé par le mycologue britannique David Hawksworth (en) en 2001, est régulièrement cité. Il est alors basé sur une diversité fongique totale de l'ordre de 1,5 million d'espèces et extrapolé à partir des 14 000 macrochampignons reconnus à l'époque, en considérant qu'ils sont environ 50 % mieux connus et en tenant compte de la proportions de nouvelles espèces découvertes dans les régions tropicales et de l'ampleur du phénomène de spéciation cryptique[17].
En 2007, une méta-analyse des données de la diversité des principaux groupes taxinomiques de macrochampignons en provenance des principales régions géographiques du monde a compilé 21 679 noms. Les contributeurs de l'étude ont également rapporté un total de 35 000 espèces encore inconnues pour les régions étudiées, ce qui porterait le nombre global de macrochampignons à une estimation entre 53 000 et 110 000 espèces. Le pourcentage d'endémisme a également été calculé en relevant la part de noms uniques enregistrés pour chaque zone géographique : il varierait entre 37 % en Asie tempérée (Chine et Japon) et 72 % en Australasie[18].
Le développement des méthodes moléculaires durant les deux premières décennies du XXIe siècle ont permis de clarifier le concept d'espèce dans de nombreux genres. Il s'est accompagné de la création d'une importante « matière noire fongique » : des taxons connus uniquement par des séquences provenant de l'environnement, sans qu'aucun spécimen ne soit collecté[19]. À la lumière de ces avancées, l'estimation de la diversité des macromycètes doit être revue à la hausse et se situerait plutôt entre 220 000 et 380 000 espèces, ce qui représenterait entre 3,7 et 6,4 % de l'ensemble de la fonge[20].
Dans un écosystème donné, le nombre d'espèces fongiques poussant sur tous les substrats et pouvant être détecté par une étude sur le terrain est six fois supérieur à celui des plantes vasculaires. En s'appuyant sur l'hypothèse selon laquelle un sixième de ces espèces sont des macrochampignons, on peut grossièrement estimer que la diversité macrofongique d'une zone géographique donnée et égale à la diversité de sa flore vasculaire[17].

La biogéographie des macromycètes semble plus fortement liée à disponibilité et la qualité de différents substrats, qu'à d'autres facteurs comme la végétation ou les conditions climatiques. La préférence de substrat varie en fonction des trois grands types écologiques[22] :
- les champignons saprotrophes sont des décomposeurs organiques, qui ont des degrés divers de spécificité pour les substrats tels que l'humus, les feuilles mortes, les fruits ou les chatons en décomposition, le bois ou l'écorce des arbres (sur pied ou à terre), ou les excréments d'animaux ;
- les champignons symbiotiques (principalement ectomycorhiziens) utilisent les ressources en carbone de leur hôte et sont principalement associés aux racines des plantes ;
- les champignons parasites colonisent les plantes (phytopathogènes) ou les insectes (entomopathogènes) vivants et produisent des enzymes qui peuvent perforer les tissus de leurs hôtes pour en extraire les nutriments et l'énergie, ce qui les tue parfois.
Une étude chinoise effectuée en 2019 dans la sous-région du Grand Mékong a identifié 15 types de substrats sur lesquels poussaient près d'un millier d'espèces de macromycètes. Ils ont été répartis en quatre catégories : racines de plantes (substrat préféré par 50 % des espèces), litière (30 %), sol (15 %) et substrats rares (pour 5 % des espèces, incluant le fumier, les sporophores d'autres champignons, les insectes, les lichens et les termitières). La grande majorité (>99 %) des champignons étudiés ont montré une spécificité exclusive pour un type de substrat, indépendamment de la végétation et du climat. La distribution des préférences pour les quatre catégories de substrats est néanmoins géologiquement séparée : les champignons ectomycorhiziens en symbiose avec les racines sont beaucoup plus nombreux dans la région tempérée, alors que les saprotrophes de litière dominent sous les tropiques. Entre deux, la zone subtropicale affiche la plus grande diversité taxinomique (nombre d'espèces) et d'utilisation du substrat (y-compris les substrats rares), tout en étant majoritairement occupée par les champignons qui poussent dans le sol. Ces derniers pourraient potentiellement constitué un indicateur de la diversité macrofongique totale[22].
Principaux groupes morphologiques
[modifier | modifier le code]C'est à la morphologie de son sporophore que le néophyte comme le mycologue averti est capable de reconnaître un macromycète. Celle-ci montre une grande variété de formes et de couleurs, et si la silhouette de parasol domine l'imaginaire collectif, il en existe de nombreuses autres : éponges, palettes, boules, coupes, coraux, etc[23]. La plupart sont éphémères, de quelques heures à plusieurs jours, bien qu'il existe également des espèces annuelles. Dans la plupart des cas, le sporophore prend d'abord une forme ovoïde ou globuleuse, qui s'ouvre ensuite lentement pour découvrir la partie fertile (l'hyménophore) et permettre la dispersion des spores[24]. Ce sont les processus de production et de propagation des spores qui ont dicté, au cours de l'évolution, le développement des différentes formes adoptées par les macromycètes pour s'adapter à leur environnement[23].
Si la morphologie du sporophore a longtemps constitué la base de la classification des espèces, elle n'en constitue plus aujourd'hui un critère fiable. En effet, les analyses microscopiques puis moléculaires ont démontré que de nombreux champignons présentant une forme similaire n'étaient en réalité pas apparentés. La classification morphologique, fondée sur la forme, la taille, la texture, l'odeur ou la couleur, reste cependant très populaire[25].
Champignons à forme « classique »
[modifier | modifier le code]Ces champignons partagent la silhouette typique du champignon : en forme de parasol composé d'un chapeau (ou piléus) et d'un pied (ou stipe). Sous le chapeau, le tissu fertile est protégé de la pluie et du soleil direct, et l'éloignement du sol créé par le pied permet aux spores de parcourir une plus longue distance. Ces champignons représentent une part importante de la classe des Agaricomycetes, mais sont répartis dans des ordres qui comprennent aussi des formes très différentes[26]. Certains Ascomycètes peuvent présenter des silhouettes vaguement semblables, mais n'ont pas d'hyménophore différencié.
À lames
[modifier | modifier le code]
Les champignons à lames sont sans aucun doute la forme la plus élaborée et la plus répandue : ils représenteraient près de deux tiers des macrocmycètes[24]. Ce groupe hétérogène englobe les espèces dont la surface fertile (l'hyménium) est située au-dessous du chapeau et formé de feuillets (lames ou lamelles) disposés en rayons[27].
Une grande majorité des champignons lamellés appartiennent à l'ordre des Agaricales, qui comprend des groupes très connus comme les agarics, les amanites, les coprins, les pleurotes, etc. Mais cet ordre très diversifié qui compte près de 10 000 espèces montre une grande variété de formes différentes. Il y a aussi des champignons à lames dans d'autres ordres d'Agaricomycètes, notamment chez les Boletales (paxilles, gomphides) et chez les Russulales (russules, lactaires)[26].
À fausses lames
[modifier | modifier le code]
L'hyménium des chanterelles est plus rudimentaire que les lames et composé de plis ou de rides qui se confondent avec la chair. Ils sont décurrents, c'est-à-dire qu'ils descendent le long du pied. Le chapeau est typiquement déprimé au centre, ce qui donne à ces champignons une apparence de vase ou d'entonnoir[28].
À tubes
[modifier | modifier le code]
Les bolets se distinguent par un tissu fertile sous forme d'innombrables tubes étroits qui forment une masse spongieuse à maturité, séparable de la chair. Leurs extrémités apparaissent comme une surface trouée (poroïde) sous le chapeau[28]. Ces champignons sont en général très charnus et présentent souvent une stature robuste. Ils vivent principalement en relation étroite avec les arbres et on les retrouve surtout dans les forêts dégagées et les plantations[29].
Historiquement classés dans l'unique genre Boletus, les bolets sont désormais répartis en plusieurs genres et familles, tous membres de l'ordre des Boletales. Ce dernier contient en outre de nombreuses espèces à la morphologie non-bolétoïde.
À aiguillons
[modifier | modifier le code]
Les hydnes se démarquent par un hyménophore en forme de dents ou d'aiguillons pendant comme des stalactites. Plus de 200 espèces appartenant à plusieurs ordres et familles différents sont regroupés sous ce terme[28]. Ils sont principalement forestiers et vivent en symbiose avec les arbres, surtout les conifères. Leur croissance est assez lente, entre deux et quatre semaines pour atteindre la maturité[30].
En dehors du réceptacle conventionnel avec pied et chapeau, caractéristique du célèbre pied-de-mouton (Hydnum repandum), on rencontre des formes très variées : d'une simple couche de tissu sur un morceau de bois (forme dite « résupinée ») à une grosse tablette, en passant par des figures plus ou moins ramifiées[31]. Le genre historique Hydnum est désormais classé parmi les Cantharellales, et on rencontre des champignons à aiguillons notamment chez les Russulales, les Polyporales et les Thelephorales[26].
Champignons à forme atypique
[modifier | modifier le code]De nombreux macromycètes ont des silhouettes qui s'éloignent de la forme classique en parasol, bien que certains puissent également avoir un chapeau ou un pied. Pour certaines formes lignicoles, c'est le tronc de l'arbre hôte qui fait en quelque sorte office de pied, permettant un point de lancement plus élevé pour les spores[32].
Polypores
[modifier | modifier le code]
L'hyménophore des polypores est, comme celui des bolets, constitué de tubes, mais il forme une masse rigide et solidaire de la chair. Celle-ci est dure et coriace, avec une consistance de cuir, de liège, de fromage ou de bois[33]. Ces champignons poussent sur les arbres vivants ou morts et n'ont pas de pied : le chapeau, en forme de console ou de pétale, est directement lié au substrat[28]. Ils se développent très lentement et ne se décomposent pas facilement, ce qui fait qu'on les rencontre à toute époque de l'année et peu importe les conditions climatiques[34]. Certaines espèces sont pérennantes, c'est-à dire qu'elles peuvent vivre plusieurs années, renouvelant à chaque saison leur couche de tubes. Elles peuvent alors atteindre des proportions considérables : une espèce de la côte Pacifique de l'Amérique du Nord, Oxyporus nobilissimus, produit ainsi des fructifications pesant pas moins de 150 kg[33].
Le genre historique Polyporus appartient aux Polyporales, mais de nombreux champignons appelés « polypores » pour leur similitude morphologique sont désormais classés dans d'autres ordres, principalement parmi les Gloeophyllales, les Hymenochaetales, les Agaricales et les Russulales[26].
Clavaires
[modifier | modifier le code]
Les clavaires ont un tissu fertile non différencié et lisse qui recouvre toute leur surface externe. Elles présentent une grande diversité de formes et de couleurs : certaines ressemblent à des bâtonnets grêles ou à de minuscules massues (en latin : clava), alors que d'autres montrent une morphologie coralloïde (c'est-à-dire ramifiée) qui fait penser à des petits arbustes ou à des coraux. Ce sont des champignons à croissance plutôt lente, qui atteignent leur maturité en une à quatre semaines. La majorité des espèces sont saprotrophes et croissent principalement sur le sol, plus rarement sur le bois pourri[35].
Les analyses moléculaires ont montré que le genre historique Clavaria et la famille des Clavariaceae forment un groupe frère des principaux clades de champignons à lames, et on les classe désormais parmi les Agaricales. Les formes clavarioïdes et coralloïdes sont cependant retrouvées dans plusieurs autres ordres d'Agaricomycetes, notamment chez les Gomphales et les Cantharellales, mais aussi parmi les Russulales, les Polyporales, les Hymenochaetales , les Sebacinales et les Thelephorales[26].
Champignons gastéroïdes
[modifier | modifier le code]
La particularité de ces champignons est que la production des spores s'effectue à l'intérieur d'un réceptacle plus ou moins sphérique, évoquant une balle, une poire, un œuf ou une pomme de terre. À maturité, l'enveloppe externe se déchire et permet la dissémination par le vent ou les animaux. Ce trait morphologique a longtemps servi à classer ces espèces dans le groupe homogène des gastéromycètes, mais il s'agit en réalité d'une convergence évolutive. Les membres les plus connus de cet assemblage hétéroclite sont les vesses-de-loup et les satyres, à la forme très suggestive[28].
La morphologie gastéroïde est plutôt rare mais très largement répartie au sein des Agaricomycètes. Les espèces les plus connues sont désormais classées dans les ordres des Agaricales, des Boletales, des Phallales et des Geastrales[26].
Champignons souterrains
[modifier | modifier le code]
Les sporophores de ces champignons sont plus ou moins globuleux et se caractérisent par un développement hypogé, c'est-à-dire enfouis dans le sol. À maturité, ils sont dévorés par les animaux (grands mammifères, rongeurs, insectes, larves, etc.) qui assurent la dissémination des spores.
Les plus connus sont les truffes qui appartiennent, au sens strict, au genre Tuber. Ce dernier contient près d'une centaine d'espèces, dont seules 5 à 10 méritent un statut gastronomique. Elles poussent en symbiose avec les arbres et développent une odeur forte à maturité pour attirer les animaux fouisseurs[36]. Les truffes sont des Ascomycètes de la classe des Pezizomycetes, qui contient plus d'une centaine d'autres genres hypogés, appelées « fausses truffes » par analogie[37]. Parmi elles, les terfesses ou « truffes du désert » qui poussent en Afrique du Nord ont également une place dans la cuisine traditionnelle.
Il existe encore de nombreuses « fausses truffes » chez les Basidiomycètes, qui sont en fait des champignons gastéroïdes. Plusieurs d'entre elles ont évolué à partir d'ancêtres à lames ou à tubes, pour s'adapter à l'aridité du climat[26].
Pézizes
[modifier | modifier le code]
Les pézizes sont un groupe très hétéroclite caractérisé par un ascocarpe en coupe, l'apothécie. Il s'agit de la forme la plus répandue de macrochampignons chez les Ascomycètes. Elles ont pour la plupart une chair cassante et reposent directement sur le substrat (sans pied)[28]. Les spores sont produites sur la surface interne de la coupe qui est orientée vers le ciel. À maturité, elles sont littéralement éjectées hors de la fructification et forment comme un petit nuage de fumée[38].
Il existe une centaine de genres répartis dans les classes des Pezizomycetes (ordre des Pezizales), des Leotiomycetes (ordre des Helotiales) et des Orbiliomycetes (qui ne contient qu'une seule famille, les Orbiliaceae).
Morilles et helvelles
[modifier | modifier le code]
Certains Ascomycètes présentent également des silhouettes composées d'un pied surmonté d'un chapeau. Ce dernier peut avoir la forme d'une éponge chez les morilles ou de cloche lisse ou plissée chez les verpes, ou encore de selle de cheval chez les helvelles, ou de cerveau chez les gyromitres[28]. Ces champignons sont en réalité très proches des pézizes : ils sont composés d'un assemblage d'apothécies soudées entre elles pour former, par exemple, la structure alvéolée en nid d'abeilles ou les fossettes des morilles[32].
Tous ces champignons appartiennent à l'ordre des Pezizales, qui comprend aussi des pézizes et des truffes.
Champignons gélatineux
[modifier | modifier le code]
Il s'agit d'un regroupement « fourre-tout » de Basidiomycètes qui étaient historiquement classés ensemble sur la base de leurs basides cloisonnées et de leur réceptacle plus ou moins gélatineux. La plupart sont appelées trémelles en français, car elles « tremblent » comme de la gelée. Elles sont le plus souvent difformes, mais adoptent parfois la forme d'une coupe ou d'un cerveau. Ces champignons se recroquevillent beaucoup en séchant et passent facilement inaperçus par temps sec, puis reprennent leur forme initiale à l'état humide[39]. C'est cette caractéristique qui fait notamment le succès de certaines espèces comestibles, comme le champignon noir asiatique ou l'oreille de Judas.
Les champignons gélatineux sont les principaux représentants des classes des Dacrymycetes et des Tremellomycetes, mais on en retrouve également parmi les Agaricomycetes (ordres des Auriculariales et des Sebacinales).
Champignons en croûtes
[modifier | modifier le code]
Ces champignons poussent le plus souvent sur le bois et forment de croûtes dures et tenaces. Certains restent plaqués au substrat durant tout leur développement, alors que d'autres forment ensuite un sporophore plus structuré en forme de console ou de pétale[28]. Chez les Basidiomycètes, la plupart des espèces étaient classées dans l'ordre des Corticiales, ainsi que dans la famille des Stereaceae (désormais dans l'ordre des Russulales). Les formes corticioïdes sont en réalité présentes parmi de nombreuses lignées d'Agaricomycetes[26].
Il existe également de nombreuses formes résupinées parmi les Ascomycètes, sous forme de croûte dure ou de masse spongieuse molle. Elles poussent sur le bois, ou parfois sur d'autres champignons, et sont couvertes de boutons à peine plus gros que des têtes d'épingles[40]. Ce sont les périthèces où sont produites les spores. La plupart font partie de la classe des Sordariomycetes, notamment dans la famille des Xylariaceae[41].
Ces champignons ne doivent pas être confondus avec les nombreux lichens, qui peuvent également former des croûtes.
Autres formes
[modifier | modifier le code]
Il existe encore de nombreuses autres formes de macrochampignons. Chez les Ascomycètes, on trouve ainsi des champignons plus ou moins coriaces (ce qui les différencie des clavaires à la chair plutôt fragile) en forme de doigt ou de bois de cerf (xylaires), de massue (cordyceps), de langue (géoglosses), de spatule (spatulaires) , de clou (léoties), etc[28]. Ils appartiennent aux classes des Sordariomycetes, des Geoglossomycetes et des Leotiomycetes.
Parmi les Basidiomycètes, on notera encore la morphologie cyphelloïde, en forme de cupule ou de tubule, qui caractérise certaines Agaricales. Elles se distinguent des Ascomycètes de formes équivalentes par le fait qu'elles sont toujours tournées vers le sol (alors que les coupes des pézizes sont orientées vers le haut)[26].
Menaces et conservation
[modifier | modifier le code]Défis et réponses
[modifier | modifier le code]Malgré le rôle primordial des macrochampignons dans les processus écologiques et l'importante dépendance des plantes envers les associations mycorhiziennes, les efforts pour leur conservation n'ont sérieusement commencé qu'à la fin du XXe siècle[20]. Le mouvement est d'abord principalement européen et débute au 9e Congrès des mycologues européens tenu à Oslo en 1985, où sont présentés les premières données montrant un déclin des macromycètes, notamment aux Pays-Bas. À la suite de cette annonce est établi le Conseil européen pour la conservation des champignons (European Council for the Conservation of Fungi, ECCF)[42]. Le défi est en effet d'importance pour la diversité biologique du vieux continent, qui compterait plus de 15 000 espèces de macrochampignons, à comparer aux estimations pour d'autres groupes d'organismes qui font par exemple état de 12 500 plantes vasculaires, 1 753 mousses, 8 470 papillons, 524 oiseaux et 226 mammifères[43].
Listes rouges nationales
[modifier | modifier le code]La première liste rouge nationale de macromycètes est établie en République démocratique allemande en 1982 et rapidement suivie par des publications dans une dizaine d'autre pays européens[42]. La Suède est le premier État à constituer un comité permanent chargé de la maintenance d'une liste nationale en 1990 et reste un modèle en la matière[43].

- Liste officielle
- >1 000 taxons
- 100-1 000 taxons
- <100 taxons Liste officieuse
- >1 000 taxons
- 100-1 000 taxons
- <100 taxons
La situation est cependant très variable en fonction des pays. Par exemple dans les pays francophones :
- la France n'a pas de liste rouge de macromycètes à l'échelle nationale, mais possède un catalogue sans valeur officielle des lichens[44]. Un projet de « Liste rouge des champignons menacés en France métropolitaine » a débuté en 2013 et a établi une méthodologie basée sur celle de l'UICN en 2015[45]. Il existe plusieurs listes régionales sans statut officiel et quatre anciennes régions administratives ont obtenu une labellisation de leurs listes rouges régionales de champignons supérieurs par le Comité français de l’UICN[46] : l'Alsace (3 926 espèces évaluées)[47], la Franche-Comté (3 399 espèces évaluées)[48], Midi-Pyrénées (4 597 espèces évaluées)[49] et le Poitou-Charentes (3 191 espèces évaluées)[50] ;
- la Suisse dispose d'une « Liste rouge des champignons supérieurs » depuis 1997[42]. L'édition de 2007 a pris en compte 4 960 espèces, dont 2 956 ont pu être évaluées et 937 considérées comme menacées[51] ;
- le Canada a adopté une Loi sur les espèces en péril en 2002. Le registre associé contient 29 lichens, mais aucun champignon supérieur[52]. Le rapport « Espèces sauvages » de 2015 a évalué 87 espèces de macrochampignons (le pays en compterait plus de 8 000) mais aucune n'a été jugée en péril à l'échelle nationale[53] ;
- la Belgique n'a pas de liste rouge nationale, mais il existe une liste partielle sans statut officiel pour la Flandre[54].
Liste rouge internationale
[modifier | modifier le code]Au niveau mondial, la Liste rouge de l'UICN n'a compté qu'une seule espèce de champignon entre 2006 et 2015. En 2018, le nombre d'espèces évaluées était de 56, alors que la liste comprenait 68 054 espèces d'animaux et 25 452 espèces de plantes[44]. Ces nombres sont néanmoins en constante augmentation, et la version 2020 de la liste rouge comprend 285 espèces évaluées, dont une trentaine de lichens, parmi lesquelles 208 sont considérées comme menacées[55].


| Taxon | Total | % | ||||||
|---|---|---|---|---|---|---|---|---|
| Agaricales | 3 | 21 | 55 | 18 | 20 | 9 | 126 | 44 % |
| Boletales | 0 | 9 | 7 | 7 | 14 | 3 | 40 | 14 % |
| Russulales | 0 | 7 | 3 | 2 | 12 | 1 | 25 | 9 % |
| Polyporales | 0 | 6 | 5 | 3 | 2 | 2 | 18 | 6 % |
| Autres Agaricomycetes | 3 | 5 | 9 | 4 | 2 | 2 | 25 | 9 % |
| Ustilaginomycetes (charbons) | 0 | 0 | 2 | 0 | 0 | 0 | 2 | 0,7 % |
| Basidiomycota | 6 | 48 | 81 | 34 | 50 | 17 | 236 | 83 % |
| Lecanoromycetes (lichens) | 9 | 12 | 5 | 1 | 2 | 0 | 29 | 10 % |
| Autres Pezizomycotina | 1 | 1 | 5 | 5 | 3 | 5 | 20 | 7 % |
| Ascomycota | 10 | 13 | 10 | 6 | 5 | 5 | 49 | 17 % |
| Total | 16 | 61 | 91 | 40 | 55 | 22 | 285 | 100 % |
Usages humains
[modifier | modifier le code]La principale utilisation des macromycètes est atuellement l'alimentation. Alors que la plupart des champignons cultivés appartiennent à seulement cinq genres (Agaricus, Auricularia, Flammulina, Lentinula et Pleurotus), un grand nombre d'espèces sauvages sont cueillis dans la nature pour la consommation locale ou pour le commerce[20].
Alimentation
[modifier | modifier le code]
Les macrochampignons sauvages sont récoltés pour l’alimentation et pour générer des revenus dans plus de 80 pays. Le nombre de champignons comestibles est relativement limité par rapport au nombre total d'espèces connues, mais offre néanmoins une diversité importante documentée pour un peu plus d'un millier de taxons. Certains ont une valeur économique en termes d’exportation, mais leur signification principale réside dans l'utilisation comme aliment de subsistance dans les pays en développement. En Afrique centrale et du sud, les champignons fournissent ainsi une contribution notoire pendant les mois de soudure. Ailleurs, ils sont un complément estimé aux régimes alimentaires des populations rurales. Les champignons sauvages comestibles sont également vendus sur les marchés locaux et peuvent fournir des sources de revenus importantes. À une plus grande échelle, la demande en champignons sauvages de l’Europe et du Japon fait gagner des sommes significatives à des pays comme le Bhoutan, la Corée du Nord ou le Pakistan[56].
L'un des paradoxes de la consommation de champignons est cependant leur faible valeur nutritive : quantitativement, ils sont principalement composés d'eau (entre 85 et 95 %) et leur apport énergétique est de 300 à 400 kcal pour 100 g de poids sec, ce qui est moins que de nombreux fruits et légumes. Qualitativement, ils contiennent de faibles quantités de la plupart des acides aminés essentiels, des vitamines (surtout du groupe B) et de minéraux essentiels (sauf le fer). Dans les pays riches, les champignons sont donc consommés la plupart du temps pour leurs seules qualités gustatives[57].
Médecine
[modifier | modifier le code]
Les propriétés médicinales des macromycètes sont connues depuis des siècles en médecine traditionnelle. L'histoire de l'utilisation de différents types d'extraits fongiques montrant une activité immunostimulante, anti-inflammatoire ou anticancéreuse remonte à l'ancien Japon, à la Chine et à d'autres pays d'Extrême-Orient. Dans de nombreux pays industrialisés, comme les États-Unis, le Canada ou Israël, les réalisations scientifiques de ces régions sont utilisées pour mettre en œuvre des méthodes thérapeutiques complémentaires[58]. Les propriétés médicinales d'environ 700 espèces de macrochampignons ont été prouvés scientifiquement[59].
Les substances présentant des propriétés pharmacologiques les mieux documentées sont les polysaccharides. Ils sont souvent appelés « modificateurs de la réponse biologique (en) » et permettraient de prévenir la carcinogénèse et les métastases tumorales en augmentant les capacités de l'organisme à se défendre lui-même. Le mécanisme n'est pas encore complètement compris, mais il semblerait que les polysaccharides activent les cellules immunitaires : ils stimuleraient la division lymphocytaire et macrophagique, ainsi que la synthèse des cytokines (interleukines, interférons et immunoglobulines)[60].
Parmi les macrochampignons utilisés en oncologie, les plus populaires sont les espèces du genre Ganoderma, et particulièrement le Ganoderme luisant (Ganoderma lucidum), connu sous le nom de Reishi au Japon. D'autres célébrités asiatiques comme le Shiitaké (Lentinula edodes), le Schizophylle commun (Schizophyllum commune), ou la Tramète versicolore (Trametes versicolor) contiennent des polysaccharides qui sont isolés et étudiés pour leurs propriétés anticancéreuses depuis les années 1970[58].
Utilisations rituelles et récréatives
[modifier | modifier le code]Toxicologie
[modifier | modifier le code]
La mycologie médicale distingue les micromycètes, qui causent des maladies humaines par eux-mêmes (mycoses) ou par ingestion d'aliments contaminés par leurs métabolites (mycotoxicoses), des macromycètes, dont certains sont vénéneux et peuvent provoquer des intoxications. Si les « grands champignons » d'Europe, d'Amérique du Nord et d'Afrique du Nord sont bien connus, ceux des autres continents, et notamment les espèces tropicales, le sont nettement moins. De façon globale, les champignons vraiment toxiques sont assez rares, et ceux dont l'ingestion est mortelle sont fort peu nombreux[62]. Ainsi, sur les quelque 5 000 espèces de macromycètes dont la classification est établie, une centaine seulement sont connus comme toxiques pour l'humain et une vingtaine a pu être responsable de décès[57],[61]. Néanmoins, le profil toxicologique de la plupart des espèces n'a pas été étudié. L'intoxication aigüe résulte dans la plupart des cas d'une confusion alimentaire[57].
Il existe une douzaine de syndromes mycotoxiques définis par des symptômes caractéristiques et leur délai d'apparition. On distingue classiquement les syndromes d'incubation courte (moins de 6 heures), qui représentent des atteintes fonctionnelles n'engageant qu'exceptionnellement le pronostic vital, et les syndromes d'incubation longue (plus de 6 heures), moins fréquents mais qui se caractérisent par des atteintes hépatiques ou rénales pouvant entrainer la mort[57].
L'épidémiologie des intoxications aux champignons n'est pas très détaillée et son incidence n'est pas bien définie. On estime qu'elles sont certainement sous- diagnostiquées et sous-rapportées : elles ne représentent qu'au maximum 1 % du nombre total d'intoxications[61]. En Europe de l'Ouest, 50 à 100 décès par année seraient imputables à l'ingestion de champignons toxiques. Ces chiffres sont inférieurs en Amérique du Nord[63]. En France métropolitaine, 10 625 cas ont été rapportés entre 2010 et 2017, dont 239 cas graves et 22 décès[64].
Aspects sociologiques et culturels
[modifier | modifier le code]Sociétés mycophiles et mycophobes
[modifier | modifier le code]
Les fondements de l’ethnomycologie sont posés en 1957 par un couple new-yorkais, Valentina et Robert Gordon Wasson, dont la thèse est relayée en France par l'anthropologue Claude Lévi-Strauss[65]. Ils racontent que c'est au cours d'une promenade en 1927 dans les montagnes Catskill qu'ils découvrent par hasard la ligne de démarcation qui divise, selon eux, l’humanité tout entière : en tombant sur des champignons, Madame Wasson qui est née en Russie s'extasie, alors que son époux, Américain de souche, peine à comprendre cet enthousiasme. À partir de cette expérience, ils réalisent bientôt que les Russes sont culturellement mycophiles, alors que les Anglo-Saxons sont intrinséquement mycophobes[66]. La différence de traitement dans les traditions littéraires respectives des deux cultures en est une preuve frappante. Si la littérature russe regorge de mentions bienveillantes aux champignons, on ne trouve que des descriptions d'horreur et de dégoût dans la littérature anglaise : le grand poète romantique Shelley témoigne ainsi des « champignons dont s’écaille la moisissure jusqu’à ce que leur pied épais semble un poteau de supplice, au sommet duquel frémissent encore des lambeaux de chair. »[65].
D'après Lévi-Strauss, les Français occupent une position intermédiaire entre la dévotion et la tendresse dont les Slaves entourent les champignons et l’horreur que ceux-ci inspirent aux Anglo-Saxons et aux peuples germaniques. Comme la plupart des habitants du bassin méditerranéen, dont les Italiens et les Catalans, les Provençaux sont mycophiles, alors que le rapport est ambigu dans le reste du pays[65]. Pour expliquer ces attitudes très différentes et ces réactions passionnelles au sein d'un même continuum civilisationnel, les époux Wasson et Lévi-Strauss évoquent l'hypothèse d'un culte ancestral des champignons, comprenant des rites hallucinatoires utilisant, par exemple, l'Amanite tue-mouches. Ce genre de cultes dont il subsiste encore des traces chez certains peuples de Sibérie orientale auraient été refoulés par les invasions celtiques et germaniques d'abord, puis avec un succès inégal par le christianisme[67]. Le mélange de révérence et d’effroi caractéristique du sentiment de sacré se serait dissocié et aurait libéré, selon les sociétés, tantôt la dévotion et l’attachement pour les champignons, tantôt une l'horreur imprégnée d’une sorte de respect mystique[65].

Par la suite, des définitions plus complètes de cette dichotomie ont été construites et reproduites pour d'autres régions et peuples d'Asie, du Pacifique Sud et des Amériques. Les sociétés mycophiles manifestent un intérêt particulier pour les champignons, qui font partie de leur alimentation, de leur médecine traditionnelle, ainsi que des cérémonies religieuses et des pratiques de guérison. En revanche, les sociétés mycophobes montrent une aversion, une attitude de mépris ou même de peur. Leurs membres essaient de ne pas toucher les champignons, les associent à la pourriture, n'ont pas de noms traditionnels pour en qualifier les différentes espèces et donc ne peuvent pas identifier celles présentes sur leur territoire. Pour les régions mésoaméricaines et amazoniennes, le phénomène a été décrit comme associé aux zones écologiques : la mycophilie prédomine chez les peuples des hautes terres et la mycophobie chez ceux des basses terres[68].
Ces différences culturelles ont une influence directe sur certains domaines, comme par exemple les aspects législatifs relatifs à la consommation et au commerce de champignons sauvages. Ainsi, au sein de l'Union européenne, les pays de langues germaniques (anglais, allemand et néerlandais), qui sont clairement mycophobes, n'ont généralement pas de directives ou de législation spécifiques aux champignons : la cueillette et la vente n'y sont pas une question d'intérêt public, et la population ne consomme que quelques espèces, la plupart cultivées. Les autres pays sont plutôt mycophiles : dans certaines régions, leurs citoyens récoltent et consomment de grandes quantités de nombreuses espèces différentes de champignons sauvages. En conséquence, ils sont obligés de publier des directives publiques pour la commercialisation en raison de problèmes de sécurité alimentaire. On constate également l'existence quatre différentes traditions mycophiles sur le continent, caractérisées par des prédilections de champignons distinctes. Les pays de langue romane d'Europe de l'Ouest consomment par exemple beaucoup plus d'amanites comestibles, de coprins ou de morilles, alors que les pays d'Europe de l'Est apprécient spécialement les bolets du genre Suillus et les Scandinaves préfèrent les russules. Les pays slaves montrent deux traditions bien distinctes entre l'ex-Yougoslavie et les pays d'Europe de l'Est. Ces « cultures du champignon » ont une influence plus importante sur les données de consommation que d'autres facteurs comme le climat, le type de végétation ou la répartition biogéographique des espèces[69].
Arts et culture
[modifier | modifier le code]
Les représentations culturelles et artistiques des champignons concernent principalement des macromycètes.
Transitions en cours
[modifier | modifier le code]
Cinq « révolutions » seraient actuellement en cours dans l'approche des champignons par les sociétés modernes[70]. La première concerne la reconnaissance de leurs fonctions physiologiques et écologiques. L'importance des mycorhizes, connues pourtant dès la fin du XIXe siècle, a longtemps été ignorée. Leur rôle dans les écosystèmes est cependant primordial et un arbre adulte est parfois associé à plus d'une centaine d'espèces qui constituent avec lui une communauté de vie[71]. La grande question de l'adaptation au changement climatique est néanmoins en train de faire évoluer les perspectives et l'on commence à ne plus considérer les plantes comme si elles vivaient seules. Ainsi. le projet de Grande muraille verte prévu pour faire obstacle à la désertification en Afrique intègre la sélection et l'utilisation de champignons mycorhiziens, qui absorberont l'eau au bénéfice des plantes[72].
Deux autres évolutions importantes touchent à l'alimentation. À une époque où l'on prend conscience que les ressources de la planète sont comptées, la valorisation d'aliments alternatifs, comme les algues ou les insectes, se développe. Dans ce contexte, la manne forestière offerte par les champignons et qui accompagne la sylviculture présente un intérêt croissant[70]. En parallèle, la gastronomie s'intéresse à inventer une « cuisine du troisième règne » et certains chefs étoilés comme Régis Marcon innovent pour donner une place nouvelle aux champignons[73].
Dans ce même esprit de redécouverte du potentiel des champignons, la valorisation des biomolécules fongiques pour la santé humaine démontre une transition intéressante pour des organismes encore souvent considérés comme globalement nocifs. Après avoir puisé dans les pharmacopées traditionnelles des pays asiatiques à longue tradition mycophile, la recherche scientifique s'intéresse à des espèces pourtant bien connues des mycophages mais dont on ignorait les propriétés médicinales, comme le Pied-bleu, le Faux mousseron ou le Pleurote du panicaut[70].
Enfin, une cinquième révolution concernerait la valeur symbolique donnée au champignon. Il identifierait désormais un terroir et incarnerait le lien souvent perdu avec un monde rural et un patrimoine familial menacés de disparition par les bouleversements récents de mode de vie. Et la fièvre qui s'empare du cueilleur de champignons en début de saison s'expliquerait en partie par la perspective d'une parenthèse de liberté nomade dans une vie sédentaire contrainte[70].
Annexes
[modifier | modifier le code]Notes
[modifier | modifier le code]- Le statut de sporophore des galles produites par certaines espèces n'est pas consensuel.
Références
[modifier | modifier le code]- Informations lexicographiques et étymologiques de « macromycète » dans le Trésor de la langue française informatisé, sur le site du Centre national de ressources textuelles et lexicales.
- Després 2012, Glossaire.
- Robert Kühner, « La notion d'espèce chez les champignons supérieurs », Bulletin mensuel de la Société linnéenne de Lyon, vol. 45, no 10, , p. 17–48 (ISSN 0366-1326, DOI 10.3406/linly.1976.10285, lire en ligne, consulté le ).
- Bureau de la traduction, « macromycète », sur TERMIUM Plus®, la banque de données terminologiques et linguistiques du gouvernement du Canada, (consulté le ).
- Office québécois de la langue française, « macromycète », sur Le grand dictionnaire terminologique, (consulté le ).
- Després 2012, La nomenclature.
- (en) Richard K. Grosberg et Richard R. Strathmann, « The Evolution of Multicellularity: A Minor Major Transition? », Annual Review of Ecology, Evolution, and Systematics, vol. 38, no 1, , p. 621–654 (ISSN 1543-592X et 1545-2069, DOI 10.1146/annurev.ecolsys.36.102403.114735, lire en ligne, consulté le ).
- (en) László G. Nagy, Gábor M. Kovács et Krisztina Krizsán, « Complex multicellularity in fungi: evolutionary convergence, single origin, or both? », Biological Reviews, vol. 93, no 4, , p. 1778–1794 (DOI 10.1111/brv.12418, lire en ligne, consulté le ).
- Després 2012, La classification des champignons.
- Després 2012, Les Basidiomycètes.
- (en) László G. Nagy, Robin A. Ohm, Gábor M. Kovács, Dimitrios Floudas et al., « Latent homology and convergent regulatory evolution underlies the repeated emergence of yeasts », Nature Communications, vol. 5, no 1, , p. 4471 (ISSN 2041-1723, DOI 10.1038/ncomms5471, lire en ligne, consulté le ).
- (en) Ulrich G. Mueller, « Ant versus Fungus versus Mutualism: Ant‐Cultivar Conflict and the Deconstruction of the Attine Ant‐Fungus Symbiosis », The American Naturalist, vol. 160, no S4, , S67–S98 (ISSN 0003-0147 et 1537-5323, DOI 10.1086/342084, lire en ligne, consulté le ).
- (en) Caio A. Leal-Dutra, Gareth W. Griffith, Maria Alice Neves, David J. McLaughlin, Esther G. McLaughlin, Lina A. Clasen et Bryn T. M. Dentinger, « Reclassification of Pterulaceae Corner (Basidiomycota: Agaricales) introducing the ant-associated genus Myrmecopterula gen. nov., Phaeopterula Henn. and the corticioid Radulomycetaceae fam. nov. », IMA Fungus, vol. 11, no 1, , p. 2 (ISSN 2210-6359, DOI 10.1186/s43008-019-0022-6, lire en ligne, consulté le ).
- Després 2012, Les Ascomycètes.
- (en) Matthew E. Smith, Andrii Gryganskyi, Gregory Bonito, Eduardo Nouhra, Baldomero Moreno-Arroyo et Gerald Benny, « Phylogenetic analysis of the genus Modicella reveals an independent evolutionary origin of sporocarp-forming fungi in the Mortierellales », Fungal Genetics and Biology, vol. 61, , p. 61–68 (DOI 10.1016/j.fgb.2013.10.001, lire en ligne, consulté le )
- (en) Delivering Alien Invasive Species Inventories for Europe (DAISIE), chap. 11 « List of Species Alien in Europe and to Europe », dans Handbook of Alien Species in Europe, vol. 3, Springer Netherlands, , 133–263 p. (ISBN 978-1-4020-8279-5, DOI 10.1007/978-1-4020-8280-1_11, lire en ligne), p. 140.
- (en) David L. Hawksworth, « The magnitude of fungal diversity: the 1.5 million species estimate revisited », Mycological Research, vol. 105, no 12, , p. 1422–1432 (DOI 10.1017/S0953756201004725, lire en ligne, consulté le ).
- (en) Gregory M. Mueller, John P. Schmit, Patrick R. Leacock, Bart Buyck et al., « Global diversity and distribution of macrofungi », Biodiversity and Conservation, vol. 16, no 1, , p. 37–48 (ISSN 0960-3115 et 1572-9710, DOI 10.1007/s10531-006-9108-8, lire en ligne, consulté le ).
- (en) Martin Ryberg et R. Henrik Nilsson, « New light on names and naming of dark taxa », MycoKeys, vol. 30, , p. 31–39 (ISSN 1314-4049 et 1314-4057, PMID 29681731, PMCID PMC5904500, DOI 10.3897/mycokeys.30.24376, lire en ligne, consulté le ).
- (en) David L. Hawksworth, chap. 1 « The macrofungal resource : extent, current utilization, future prospects, and challenges », dans Kandikere Ramaiah Sridhar & Sunil Kumar Deshmukh, Advances in macrofungi : diversity, ecology and biotechnology, Boca Raton, CRC Press, , 366 p. (ISBN 978-0-429-50407-5, 0-429-50407-1 et 978-0-429-99580-4, OCLC 1083671285, lire en ligne), p. 1-9.
- (en) Anne Pringle et Else C. Vellinga, « Last Chance to Know? Using Literature to Explore the Biogeography and Invasion Biology of the Death Cap Mushroom Amanita phalloides (Vaill. ex Fr. :Fr.) Link », Biological Invasions, vol. 8, no 5, , p. 1131–1144 (ISSN 1387-3547 et 1573-1464, DOI 10.1007/s10530-005-3804-2, lire en ligne, consulté le ).
- (en) Lei Ye, Huili Li, Peter E. Mortimer, Jianchu Xu Xu, Heng Gui, Samantha C. Karunarathna, Amit Kumar, Kevin D. Hyde et Lingling Shi, « Substrate Preference Determines Macrofungal Biogeography in the Greater Mekong Sub-Region », Forests, vol. 10, no 10, , p. 824 (ISSN 1999-4907, DOI 10.3390/f10100824, lire en ligne, consulté le ).
- Lamoureux et Sicard 2005, Les principales formes de champignons, p. 18.
- Després 2012, Les propriétés et les formes des sporocarpes.
- Després 2012, Les systèmes de classification.
- (en) David S. Hibbett, « After the gold rush, or before the flood? Evolutionary morphology of mushroom-forming fungi (Agaricomycetes) in the early 21st century », Mycological Research, vol. 111, no 9, , p. 1001–1018 (DOI 10.1016/j.mycres.2007.01.012, lire en ligne, consulté le ).
- Lamoureux et Sicard 2005, Les champignons à lames, p. 157.
- Després 2012, L'anatomie des autres macromycètes.
- Lamoureux et Sicard 2005, Les bolets, p. 107.
- Lamoureux et Sicard 2005, Les hydnes, p. 141.
- Groves 1981, p. 250.
- Lamoureux et Sicard 2005, Les principales formes de champignons, p. 20.
- Groves 1981, p. 247.
- Lamoureux et Sicard 2005, Les polypores, p. 309.
- Lamoureux et Sicard 2005, Les clavaires, p. 327.
- Després 2012, Les truffes.
- (en) Thomas Læssøe et Karen Hansen, « Truffle trouble: what happened to the Tuberales? », Mycological Research, vol. 111, no 9, , p. 1075–1099 (DOI 10.1016/j.mycres.2007.08.004, lire en ligne, consulté le ).
- Lamoureux et Sicard 2005, Les principales formes de champignons, p. 19.
- Groves 1981, p. 255.
- (en) Danny Miller, « Pictorial Key to Mushrooms of the Pacific Northwest » (consulté le ).
- (en) Michael Kuo, « Crust Fungi », sur MushroomExpert.Com, (consulté le ).
- (en) Eef Arnolds, chap. 4 « The future of fungi in Europe : threats, conservation and management », dans David Moore, Marijke M. Nauta, Shelley E. Evans & Maurice Rotheroe, Fungal conservation : issues and solutions, Cambridge University Press, , 276 p. (ISBN 978-0-511-56516-8 et 0-511-56516-X, OCLC 704520157, lire en ligne), p. 64-80.
- (en) Beatrice Senn-Irlet,, Jacob Heilmann-Clausen, David Genney et Anders Dahlberg, European Council for Conservation of Fungi (ECCF), Guidance for Conservation of Macrofungi in Europe, Strasbourg, The Directorate of Culture and Cultural and Natural Heritage, Council of Europe, , 39 p. (lire en ligne).
- (en) A. Martyn Ainsworth, Cátia Canteiro, Anders Dahlberg, Brian Douglas et al., « Conservation of fungi », dans State of the World’s Fungi 2018, Kew, Royal Botanic Gardens, , 88 p. (ISBN 9781842466780, lire en ligne), p. 70-77.
- Société mycologique de France, « Liste rouge des champignons menacés en France métropolitaine », sur MycoFrance.fr (consulté le ).
- Comité français de l’UICN, « Tableau de bord des Listes rouges régionales des espèces menacées », (consulté le ).
- Jean-Luc Muller, Patrick Laurent et Dominique Schott, La Liste rouge des Champignons supérieurs menacés en Alsace, SMHR, SEMHV, SMS, ODONAT, , 108 p. (lire en ligne).
- Daniel Sugny, Pierre Beirnaert, Alain Billot, Martine et Michel Caillet, Jean-Pierre Chevrolet, Laurent Galliot, Raymond Herbert et Gilbert Moyne, Liste rouge des champignons supérieurs de Franche-Comté, Lunéville, Fédération Mycologique de l’Est, Conservatoire National Botanique de Franche-Comté et Société Botanique de Franche-Comté, , 114 p. (lire en ligne).
- Gilles Corriol (Coordinateur), Liste rouge des champignons de Midi-Pyrénées, Conservatoire botanique national des Pyrénées, , 20 p. (lire en ligne).
- Éric Brugel (Coordinateur), Liste Rouge des champignons du Poitou-Charentes, Fontaine-le-Comte, GEREPI, Poitou-Charentes Nature, , 133 p. (lire en ligne).
- Beatrice Senn-Irlet, Guido Bieri et Simon Egli (trad. de l'allemand par Angéline Bedolla), Liste rouge des champignons supérieurs menacés en Suisse, Berne, Office fédéral de l’environnement, , 94 p. (lire en ligne).
- « Registre public des espèces en péril », sur le site officiel du gouvernement du Canada, (consulté le ).
- Conseil canadien pour la conservation des espèces en péril, Espèces sauvages 2015 : la situation générale des espèces au Canada, Groupe de travail national sur la situation générale, , 128 p. (lire en ligne).
- (nl) Ruben Walleyn et Annemieke Verbeken, Een gedocumenteerde Rode Lijst van enkele groepen paddestoelen (macrofungi) van Vlaanderen [« Une liste rouge documentée de certains groupes de champignons (macrochampignons) de Flandre »], Bruxelles, Instituut voor Natuurbehoud, , 84 p. (lire en ligne).
- (en) Union internationale pour la conservation de la nature, « Summary Statistics », sur The IUCN Red List of Threatened Species, (consulté le ).
- Eric Boa, Champignons comestibles sauvages : vue d'ensemble sur leurs utilisations et leur importance pour les populations, t. 17, Rome, Organisation des Nations unies pour l'alimentation et l'agriculture, coll. « Produits forestiers non ligneux », , 157 p. (ISBN 92-5-205157-0 et 978-92-5-205157-2, OCLC 181335189, lire en ligne).
- Philippe Saviuc, chap. 4 « Intoxications par les champignons supérieurs », dans Christian Ripert, Mycologie médicale, Paris, Lavoisier, , 750 p. (ISBN 978-2-7430-6488-4, OCLC 948185240, lire en ligne), p. 121-160.
- (en) Dorota Hilszczańska, « Medicinal properties of macrofungi », Forest Research Papers, vol. 73, no 4, , p. 347-353 (ISSN 2082-8926 et 1732-9442, DOI 10.2478/v10111-012-0033-1, lire en ligne, consulté le ).
- (en) Wasser Solomon P., « Medicinal mushrooms as a source of antitumor and immunomodulating polysaccharides », Applied Microbiology and Biotechnology, vol. 60, no 3, , p. 258–274 (ISSN 0175-7598 et 1432-0614, DOI 10.1007/s00253-002-1076-7, lire en ligne, consulté le ).
- (en) Mohammad-Fata Moradali, Hossein Mostafavi, Shirin Ghods et Ghorban-Ali Hedjaroude, « Immunomodulating and anticancer agents in the realm of macromycetes fungi (macrofungi) », International Immunopharmacology, vol. 7, no 6, , p. 701–724 (DOI 10.1016/j.intimp.2007.01.008, lire en ligne, consulté le ).
- (en) Gianfranco Cervellin, I. Comelli, G. Rastelli, F. Sanchis-Gomar et al., « Epidemiology and clinics of mushroom poisoning in Northern Italy: A 21-year retrospective analysis », Human & Experimental Toxicology, vol. 37, no 7, , p. 697–703 (ISSN 0960-3271 et 1477-0903, DOI 10.1177/0960327117730882, lire en ligne, consulté le ).
- Christian Ripert, Mycologie médicale, Paris, Lavoisier, , 750 p. (ISBN 978-2-7430-6488-4, OCLC 948185240, lire en ligne), « Introduction et généralités », p. 3.
- (en) Bita Dadpour, Shahrad Tajoddini, Maliheh Rajabi et Reza Afshari, « Mushroom Poisoning in the Northeast of Iran; a Retrospective 6-Year Epidemiologic Study », Archives of Academic Emergency Medicine, vol. 5, no 1, (ISSN 2645-4904, DOI 10.22037/aaem.v5i1.147, lire en ligne, consulté le ).
- Sandra Sinno-Tellier, Chloé Bruneau, Jamel Daoudi, Chloé Greillet, Agnès Verrier et Juliette Bloch, « Surveillance nationale des intoxications alimentaires par des champignons : bilan des cas rapportés au réseau des centres antipoison de 2010 à 2017 en France métropolitaine », Bulletin épidémiologique hebdomadaire, no 33, , p. 666-678 (lire en ligne).
- Claude Lévi-Strauss, « Dis-moi quels champignons... », La lettre du Collège de France, no Hors-série 2, , p. 38–40 (ISSN 1628-2329 et 2109-9219, DOI 10.4000/lettre-cdf.222, lire en ligne, consulté le ).
- (en) Valentina Pavlovna Wasson et R. Gordon Wasson, Mushrooms, Russia and History, New York, Pantheon Books, , 432 p. (lire en ligne).
- Claude Lévi-Strauss, « Les Champignons dans la culture. À propos d'un livre de M. R. G. Wasson », L'Homme, vol. 10, no 1, , p. 5–16 (ISSN 0439-4216, DOI 10.3406/hom.1970.367101, lire en ligne, consulté le ).
- (en) Felipe Ruan-Soto, Javier Caballero, Carlos Martorell, Joaquín Cifuentes, Alma Rosa González-Esquinca et Roberto Garibay-Orijel, « Evaluation of the degree of mycophilia-mycophobia among highland and lowland inhabitants from Chiapas, Mexico », Journal of Ethnobiology and Ethnomedicine, vol. 9, no 1, , p. 36 (ISSN 1746-4269, PMID 23706130, PMCID PMC3735042, DOI 10.1186/1746-4269-9-36, lire en ligne, consulté le ).
- (en) Ursula Peintner, Stefanie Schwarz, Armin Mešić, Pierre-Arthur Moreau, Gabriel Moreno et Philippe Saviuc, « Mycophilic or Mycophobic? Legislation and Guidelines on Wild Mushroom Commerce Reveal Different Consumption Behaviour in European Countries », PLoS ONE, vol. 8, no 5, , e63926 (ISSN 1932-6203, PMID 23704957, PMCID PMC3660358, DOI 10.1371/journal.pone.0063926, lire en ligne, consulté le ).
- Jean Rondet et Fernando Martinez-Peña, Territoires mycologiques : Les champignons au service des forêts et des hommes, Dijon, Educagri Editions, , 148 p. (ISBN 979-10-275-0088-8, OCLC 966115246, lire en ligne), « Cinq révolutions dans l'approche des champignons », p. 7-12.
- J. André Fortin, Christian Plenchette et Yves Piché, Les mycorhizes : l'essor de la nouvelle révolution verte, Versailles, Editions Quae, , 163 p. (ISBN 978-2-7592-2433-3 et 2-7592-2433-3, OCLC 936688556, lire en ligne).
- Robin Duponnois, Amadou M. Bâ, Yves Prin et Ezékiel Baudoin, « Les champignons mycorhiziens : une composante majeure dans les processus biologiques régissant la stabilité et la productivité des écosystèmes forestiers tropicaux », dans Abdoulaye Dya & Robin Duponnois, Le projet majeur africain de la Grande Muraille Verte : Concepts et mise en œuvre, Marseille, IRD Éditions, , 440 p. (ISBN 978-2-7099-1696-7, DOI 10.4000/books.irdeditions.2161., lire en ligne), p. 421–440.
- Régis Marcon et Philippe Barret, Champignons, Paris, La Martinière, , 416 p. (ISBN 978-2-7324-5483-2 et 2-7324-5483-4, OCLC 859448167, lire en ligne)
Bibliographie
[modifier | modifier le code]- Jean Després (dir.), L'univers des champignons, Les Presses de l'Université de Montréal, , 377 p. (ISBN 978-2-7606-2794-9 et 2-7606-2794-2, OCLC 892341082, lire en ligne).
- Yves Lamoureux et Matthieu Sicard, Connaître, cueillir et cuisiner les champignons sauvages du Québec, Fides, , 365 p. (ISBN 2-7621-2617-7 et 978-2-7621-2617-4, OCLC 58053351, lire en ligne).
- J. Walton Groves, Champignons comestibles et vénéneux du canada., Ottawa, Approvisionnements et Services Canada, , 336 p. (ISBN 0-660-90741-0 et 978-0-660-90741-3, OCLC 299370976, lire en ligne).

