תלסמיה
 | |
| תחום |
המטולוגיה |
|---|---|
| טיפול |
|
| קישורים ומאגרי מידע | |
| eMedicine | article/955496 article/206490 |
| MeSH | D013789 |
| MedlinePlus | 000587 |
| סיווגים | |
| ICD-10 | D56 |
| ICD-11 |
3A50, 3A50.Z |
תלסמיה היא מחלה תורשתית אוטוזומלית רצסיבית של תאי הדם האדומים. הפגם הגנטי גורם לשיעור מופחת של ייצור שרשרות ההמוגלובין (הפגם שקול להמוגלובינפתיה שהיא פגם מבני בשרשרת ההמוגלובין הגורם להעברת חמצן לא יציבה או לא נורמלית). תאי הדם פגיעים מאוד לפציעה מכנית ומתים במהירות. חולים רבים בתלסמיה מקבלים עירויי דם באופן קבוע (במרווח זמן של שבועיים עד שלושה שבועות) על מנת להתמודד עם המחלה ולשמור על אורח חיים בריא יותר במקום לחיות ללא טיפול; ניתן לבצע השתלת מח עצם אם התוצאה הראשית של העירוי – עלייה בכמות הברזל – מתחילה בעצמה להיות בעיה. השתלת מח עצם דורשת התאמה מדויקת על מנת להימנע מדחייה ומסיבוכים נוספים.
הקישור הגאוגרפי של המחלה עם אגן הים התיכון היה אחראי לשם שניתן לה: תלסה (Thalassa) היא המילה ביוונית שמשמעותה ים, ומשמעותה של היימה (Haema) היא דם. תלסמיה מתרחשת בכל האוכלוסיות והקבוצות האתניות, אולם שכיחותה משתנה בין אוכלוסיות שונות.
שכיחות המחלה
[עריכת קוד מקור | עריכה]בדרך כלל, תלסמיות שכיחות באוכלוסיות שהתפתחו באקלימים טרופיים, היכן שמחלת המלריה שכיחה. תלסמיות מקושרות במיוחד עם אפרו-אמריקאים, אנשים ממוצא מזרח-תיכוני, ואסייתים[1]. השכיחות המשוערת היא 16% באנשים מקפריסין, 3-14% בתאילנד, ו-3-8% באוכלוסיות מהודו, פקיסטן, בנגלדש וסין. המחלה שכיחה גם בצאצאים של אנשים מאמריקה הלטינית, האיים הקריביים, ומדינות ים תיכוניות (לדוגמה, ספרד). שכיחות נמוכה יותר דווחה מאנשים שחורים באפריקה (0.9%) וצפון אירופה (0.1%).
אצל הבדואים בדרום מדינת ישראל נמצא ריכוז גדול יחסית של לוקים במחלת התלסמיה. מחקר שנעשה בשנים 2009-2008 השווה בין אוכלוסיית הבדואים המתגוררת בצפון ישראל לאלו המתגוררים בדרומה, ומצא כי אחוז הלוקים במחלה בין הבדואים הדרומיים גדול פי 3–4 מאחוז הלוקים במחלה בין הבדואים של צפון הארץ. השערת המחקר, שדורשת אימות נוסף, היא שהסיבה לכך היא גנטית ונובעת מנישואי קרובים.
פתופיזיולוגיה
[עריכת קוד מקור | עריכה]
התלסמיות מסווגות בהתאם לסוג השרשרת של מולקולת ההמוגלובין שנפגעת. ב-α תלסמיות, מושפע הייצור של שרשרת ה-α גלובין, בעוד שב-β תלסמיות מושפע הייצור של שרשרת ה-β גלובין.
תלסמיות גורמות לחוסר ב-α או β גלובין, בניגוד לאנמיה חרמשית שבה יש מוטציה נקודתית ב-β גלובין.
שרשראות β גלובין מקודדות על ידי גן יחיד הנמצא על כרומוזום 11; שרשראות α גלובין מקודדות על ידי שני גנים הנמצאים בתאחיזה על כרומוזום 16. באופן זה, באדם נורמלי עם שני עותקים של כל כרומוזום, ישנם שני אתרים המקודדים את שרשרת β, וארבעה אתרים המקודדים את שרשרת α[2].
למחיקה של אחד מאתרי α יש שכיחות גבוהה באנשים ממוצא אמריקני-אפריקני או אסייתי, מה שמגדיל את הסיכוי שלהם לפתח α תלסמיות. Β תלסמיות נפוצות יותר באפרו-אמריקאים, אבל גם ביווניים ואיטלקיים.
אלפא (α) תלסמיות
[עריכת קוד מקור | עריכה]אלפא תלסמיות כוללות את הגנים HBA1 ו-HBA2, המורשים בצורה מנדלית רצסיבית. התלסמיה מקושרת גם לחסר בכרומוזום 16. α תלסמיות גורמות לירידה בייצור אלפא-גלובין, ולפיכך נוצרות פחות שרשרות אלפא-גלובין, מה שגורם לעודף בשרשרות β במבוגרים ולעודף בשרשרות γ בתינוקות. עודף שרשרות ה-β יוצר טטראמרים לא יציבים (הנקראים המוגלובין H) שיש להם עקומות שחרור חמצן שאינן זהות לאלו של המוגלובין רגיל הבנוי משרשרות אלפא ובתא. עקומות שחרור החמצן של ההמוגלובין ה"פגום" שונה בכך שהוא נוטה לקשור אליו את החמצן בצורה חזקה יותר וע"כ קשה יותר לשחרר את החמצן ממנו אל רקמות הגוף.
ישנם ארבעה אתרים גנטיים שעל פיהם מיוצר α גלובין, כאשר שניים מתוכם מגיעים מהאם ושניים מתוכם מגיעים מהאב. ככל שיותר מהאתרים מוחסרים או מושפעים ממוטציה, כך יחמירו תסמיני המחלה:
- אם כל ארבעת האתרים מושפעים, העובר לא יכול לחיות מחוץ לרחם ועשוי שלא לשרוד את ההריון: רוב העוברים מתים בלידה כתוצאה ממצב הנקרא הידרופס פטאליס, ואלו שנולדים בחיים מתים זמן קצר לאחר הלידה. הם סובלים מבצקות חמורות ויש להם מעט המוגלובין במערכת הדם ההיקפית. ההמוגלובין שכן נמצא הוא טטראמר γ מוחלט (ומכונה המוגלובין בארטס). בדרך כלל, המצב הזה כולל הורשה הומוזיגוטית של תלסמיה אלפא, סוג 1.
- אם שלושה אתרים מושפעים, נגרמת מחלת המוגלובין H. בדם נמצאים שני המוגלובינים לא יציבים, המוגלובין בארטס (טטראמר γ) והמוגלובין H (טטראמר β). לשני ההמוגלובינים הלא יציבים הללו יש זיקה גבוהה יותר לחמצן ביחס להמוגלובין רגיל, והתוצאה של זה היא העברת חמצן ירודה לרקמות. נוצר מצב של אנמיה היפוכרומית מיקרוציטית עם תאי מטרה וגופיפי היינץ (משקעים של המוגלובין H) בכתמי דם (על זכוכית נושאת של מיקרוסקופ) היקפיים. המחלה תופיע בילדות או בחיים הבוגרים המוקדמים, כאשר האנמיה והגדלת הטחול יתבלטו. הסוג הזה הוא בדרך כלל תוצאה של הורשה הטרוזיגוטית של תלסמיה אלפא מסוג 1 ומסוג 2.
- אם שני אתרים מושפעים, נגרמת תלסמיה אלפא מסוג 1. שני אתרי α מאפשרים אריתרופויזה כמעט נורמלית, למרות שיש קצת אנמיה היפוכרומית מיקרוציטית. ישנה שכיחות גבוהה (בערך 30%) של חסר באחד משני אתרי α על הכרומוזומים של אנשים ממוצא אפריקני קרוב, ובכך, ההורשה של שני כרומוזומים כאלה איננה בלתי נפוצה. ניתן להתבלבל בין המחלה בצורתה זו לבין אנמיה מחוסר ברזל ולטפל בה באופן שגוי עם ברזל. אובחנו שתי צורות של תלסמיה אלפא מסוג 1. אחת כוללת מחיקת ציס של שני אתרי האלפא על אותו כרומוזום; השנייה כוללת מחיקת טראנס של אללים על כרומוזומים הומולוגיים (מספר 16).
- אם רק אתר אחד מושפע, תיגרם תלסמיה אלפא קטנה או אלפא+ או תלסמיה אלפא מסוג 2 וההשפעות יהיו מזעריות. שלושה אתרי α-גלובין מספיקים על מנת לאפשר ייצור המוגלובין נורמלי, ואין מצב של אנמיה או היפוכרומיה באנשים במצב הזה. אנשים אלה נקראים נשאי תלסמיה α[3].
בטא (β) תלסמיות
[עריכת קוד מקור | עריכה]תלסמיות בטא (אנמיית קולי) נגרמות בעקבות מוטציות בגן HBB על כרומוזום 11, המורש גם כן בתורשה מנדלית רצסיבית. ב-β תלסמיה, מתרחשת ירידה בייצור בטא-גלובין, הגורמת לייצור נמוך מהרגיל של שרשראות בטא-גלובין. כתוצאה מכך יש רמה גבוהה של שרשראות α, אבל הן לא יוצרות טטראמרים: במקום זה, הן נקשרות לקרום התא של תאי דם אדומים וגורמות להם לנזקים.
בריכוזים גבוהים, לשרשראות יש נטייה ליצור משקעים רעילים. חומרת הנזק תלויה בסוג המוטציה. חלק מהמוטציות (βo) מונעות לחלוטין יצירה של שרשראות β; אחרות (β+) מאפשרות ייצור ברמה מסוימת של שרשרת β. לאחרונה, כמות הולכת וגדלה של דיווחים טוענת שעד 5% מהמטופלים עם בטא-תלסמיות מייצרים המוגלובין עוברי (HbF), כאשר גם לשימוש בהידרוקסי-אוריאה יש נטייה להגדיל את הייצור של HbF. אולם, המנגנון הגורם לכך עדיין לא ידוע.
לכל אדם נתון יש שני אללים ל-β-גלובין, אחד מהאם ואחד מהאב:
- אם בשני האתרים יש מוטציות תלסמיות, תיגרם אנמיה מיקרוציטית היפוכרומטית חמורה הנקראת "בטא תלסמיה גדולה" או "אנמיית קולי". ללא טיפול, המחלה תגרום למוות לפני גיל עשרים. הטיפול מורכב מעירוי דם תקופתי, כריתת טחול אם הוא מוגדל, וטיפול ברמה גבוהה מדי של ברזל אם היא קיימת. תרופה אפשרית היא באמצעות השתלת מח עצם.
- אם רק אחד מהאללים נושא מוטציה, תיגרם β תלסמיה קטנה (לעיתים היא נקראת תכונת בטא תלסמיה). מחלה זו מתבטאת באנמיה קלה עם מיקרוציטוזה. התסמינים כוללים חולשה ועייפות. ברוב המקרים ל-β תלסמיה קטנה אין תסמינים ואנשים רבים עשויים שלא להיות מודעים לכך שיש להם את ההפרעה הזאת. הגילוי כולל בדרך כלל בדיקה של גודל תאי הדם האדומים (MCV) והבחנה כי גודל התאים קטן מהנורמלי.
- תלסמיית ביניים היא מצב ביניים בין הצורה הגדולה והקטנה. אנשים הסובלים ממנה יכולים בדרך כלל לנהל חיים נורמליים אבל עשויים להזדקק לעירוי דם מפעם לפעם (לדוגמה: בזמן מחלה או הריון). צורך זה תלוי בעיקר בחומרת האנמיה.
הגורמים הגנטיים של β תלסמיות הם מאוד מגוונים ומספר מוטציות שונות עשויות לגרום להפחתה או להעלמה של סינתזת β גלובין. בדרך כלל, הכתובת העילית 0 או + מוספת לאות β על מנת לציין היעדרות מוחלטת, וייצור פגום של β בהתאמה.
ישנן שתי צורות של פגמים גנטיים עיקריים הגורמים ל- β תלסמיות:
- צורות אי החסרה: פגמים אלו כוללים בדרך כלל החלפה של בסיס אחד או החסרה/החדרה קטנה במעלה הזרם של הגן ל-β גלובין. המוטציות הנפוצות ביותר הן אלה שמתרחשות באזורי הקדם (Promoter) שלפני הגנים. מוטציות פחות נפוצות הן אלה הגורמות למגוון שחבורים והן נחשבות ככאלה שגם כן תורמות למחלה.
- צורות החסרה: חסרים מגדלים שונים המעורבים עם גן ה-β גלובין גורמים לתסמונות שונות כגון βo או נוכחות תורשתית של תסמונת ההמוגלובין העוברי.
דלתא (δ) תלסמיות
[עריכת קוד מקור | עריכה]אמנם המוגלובין באדם בוגר מורכב משרשראות אלפא ובטא, אולם כ-3% ממנו מורכב משרשראות אלפא ודלתא.
בדומה לבטא תלסמיה, מוטציות יכולות להתרחש ולהשפיע על היכולת של הגן הזה לעבור תעתוק לשרשראות דלתא.
מוטציה המונעת לחלוטין ייצור של שרשראות דלתא מסומנת δ0, בעוד שמוטציה המקטינה אבל לא מחסלת לחלוטין את יצירת שרשראות הדלתא מסומנת δ+. כאשר מורשות שתי מוטציות δ0, לא נוצר בכלל המוגלובין A2 (אלפא2, דלתא2).
אולם, מבחינה המטולוגית, המצב הזה לא פוגע בגוף כיוון שרק 2-3% מההמוגלובין הנורמלי בבן אדם הוא המוגלובין A2, לפרט יהיו מדדים המטולוגיים תקינים (ספירת אריתרוציטים, המוגלובין כולל, MCV נורמלי, גודל תאי דם אדומים וכדומה). פרטים שירשו רק מוטציית דלתא תלסמיה אחת יאופיינו על ידי כמות מוקטנת של המוגלובין A2, אולם ללא השלכות המטולוגיות כלשהן.
החשיבות בזיהוי הנוכחות של תלסמיה דלתא ניכרת במיוחד במקרים שבהם היא עשויה למסך על האבחון של תכונת בטא תלסמיה. בבטא תלסמיה ישנה עלייה בכמות ההמוגלובין A2, בדרך כלל עד לרמה של 4-6%. אולם, הקיום המקביל של מוטציית תלסמיה דלתא יפחית את הכמות של המוגלובין A2 עד לטווח התקין, ובכך יערפל על הנוכחות של בטא תלסמיה. המצב הזה עשוי להיות חשוב בייעוץ גנטי, כיוון שילד להורים שלכל אחד מהם יש תכונת תלסמיה βo יש סיכוי של אחד לארבע לסבול מבטא תלסמיה גדולה.
בשילוב עם פתולוגיות אחרות של המוגלובין
[עריכת קוד מקור | עריכה]תלסמיה יכולה להתקיים ביחד עם פתולוגיות אחרות של המוגלובין. השילובים הנפוצים ביותר הם:
- המוגלובין E / תלסמיה: נפוץ בקמבודיה, תאילנד וחלקים מהודו; דומה מבחינה קלינית לתלסמיה β גדולה או תלסמיית ביניים.
- המוגלובין S / תלסמיה: נפוץ באוכלוסיות אפריקניות ומזרח תיכוניות; דומה מבחינה קלינית לאנמיה חרמשית, עם תסמין נוסף של טחול מוגדל.
- המוגלובין C / תלסמיה: השילוב עם תלסמיה βo נפוץ באוכלוסיות אפריקניות ומזרח תיכוניות, וגורם לאנמיה המוליטית חמורה עם הגדלת טחול. השילוב עם תלסמיה β+ גורם לתסמינים פחות חמורים.
טיפול וסיבוכים
[עריכת קוד מקור | עריכה]כל מי שסובל מתלסמיה צריך להתייעץ עם המטולוג מוסמך.
תלסמיות עשויות להתקיים במקביל לחוסר בחומצה פולית או ברזל (רק בתלסמיה קטנה).
תלסמיה גדולה ותלסמיה ביניים
[עריכת קוד מקור | עריכה]חולים בתלסמיה גדולה מקבלים עירוי דם באופן תדיר שגורם לעומס ברזל. יש צורך לבצע טיפול קלאציה לברזל על מנת למנוע מהברזל לפגוע באיברים פנימיים של חולים בתלסמיה גדולה. בעקבות התפתחויות חדשות בסוג זה של טיפולים, חולים בתלסמיה גדולה יכולים לחיות לאורך זמן רב למרות מצבם. קלאטים נפוצים כוללים דפרוקסמין ודפריפרון. מבין השניים, הדפרוקסמין עדיף כיוון שנמצא קשר חלש יותר בין השימוש בו לתופעות לוואי[4] .
התלונה הנפוצה ביותר של חולים היא אי הנוחות הנגרמת מטיפולי הקלאציה. הקלאט האוראלי (כלומר, שניתן דרך הפה) דפראסירוקס אושר לאחרונה לשימוש במספר מדינות ועשוי להציע תקווה מסוימת עם הסיבוך הזה.
תלסמיה גדולה שאינה מטופלת עשויה לגרום בסופו של דבר למוות כתוצאה מאי ספיקת לב, ולפיכך בדיקה במהלך הלידה חשובה ביותר.
בשנים האחרונות, השתלת מח עצם הראתה סימנים מבטיחים במספר חולים בתלסמיה גדולה. השתלה שהצליחה עשויה לבטל את התלות של החולים בעירויי דם.
כל חולי התלסמיה מועדים לסיבוכים בריאותיים הכוללים את הטחול (שמוגדל במקרים רבים ומוסר גם כן במקרים רבים) ואבנים בכיס המרה. הסיבוכים האלה שכיחים מאוד בחולים בתלסמיה גדולה ותלסמיה ביניים.
חולים בתלסמיה ביניים מגוונים מאוד בצורכי הטיפול שלהם, כאשר הדבר תלוי בחומרת האנמיה שלהם.
תלסמיה קטנה
[עריכת קוד מקור | עריכה]בניגוד לדעה הרווחת, חולים בתלסמיה קטנה לא צריכים להימנע ממאכלים עשירים בברזל. מבחן סרום פריטין יכול לקבוע מה רמת הברזל שלהם ולהנחות אותם בטיפול עתידי אם יש צורך. תלסמיה קטנה, למרות שאיננה מאיימת על החיים, יכולה להשפיע על איכות החיים בעקבות התוצאות של אנמיה קלה עד בינונית. מחקרים הראו שתלסמיה קטנה מתקיימת במקרים רבים לצד הפרעות אחרות כגון אסתמה[5] ואפילו הפרעה דו-קוטבית[6].
מניעת תלסמיה ופיקוח
[עריכת קוד מקור | עריכה]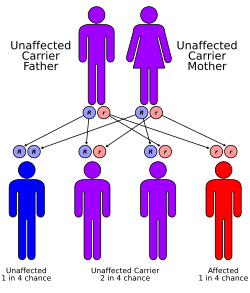
ברוב המקרים, תלסמיות α ו-β מורשות בצורה אוטוזומאלית רצסיבית. היו דיווחים על צורת הורשה דומיננטית, כאשר הראשון שבהם היה במשפחה אירית שהיו לה שתי מחיקות של 3 ו-11 זוגות בסיסים באקסון 3, שהופרעו על ידי החדרה של 5 זוגות בסיסים בגן ל-β גלובין.
על מנת שילד יחלה בצורה האוטוזומית רצסיבית, שני ההורים חייבים לשאת את הגן הפגום. אם שני ההורים הם נשאים של תכונה המוגלובינפתית, יש סיכוי של 25% בכל הריון שיולד ילד חולה. ייעוץ ומבחנים גנטיים מומלצים למשפחות שיש בהן נשאות לתלסמיה.
כיום, מעריכים כי יש בין 60–80 מיליוני אנשים החולים בתלסמיה בטא לבדה. זו הערכה גסה מאוד והמספר האמיתי של חולים בתלסמיה גדולה איננו ידוע בעקבות שכיחות המחלה במדינות העולם השלישי במזרח התיכון ובאסיה. מדינות כגון הודו, פקיסטן ואיראן מראות עלייה גדולה במספר חולי התלסמיה בעקבות מחסור בייעוץ גנטי וטיפול רפואי מתאים. ישנה דאגה גדולה שתלסמיה תהפוך לבעיה רצינית ביותר במהלך 50 השנים הבאות, כזאת שתהיה לנטל כבד על אספקת הדם של בנק הדם הבינלאומי ומערכות הבריאות בכלל. מעריכים כי בארצות הברית ישנם 1,000 אנשים החולים בתלסמיה גדולה ומספר לא ידוע של נשאים.
כמו בהפרעות גנטיות נרכשות אחרות, מומלץ לבצע סקירות לידה וייעוץ גנטי.
מדיניות סקירה קיימת בשני הצדדים של האי קפריסין על מנת להפחית את ההתרחשות של תלסמיה, כאשר מאז תחילת התוכנית בשנות ה-70 (הכוללת סקירה קדם לידתית והפלה), היא הביאה לירידה במספר הילדים הנולדים עם מחלת הדם המורשת מרמה של 1 לכל 158 לידות עד לכמעט אפס[7].
יתרונות
[עריכת קוד מקור | עריכה]היותו של אדם נשא של המחלה עשויה לתת לו רמה מסוימת של הגנה כנגד מלריה, והיא די נפוצה בקרב אנשים ממוצא איטלקי או יווני, כמו גם באזורים אפריקניים והודים. הסיבה לכך היא ככל הנראה שתאי הדם האדומים יותר רגישים לזן הפחות קטלני של המין Plasmodium vivax, ובאופן עוקב הופכים את הסביבה של תאי הדם האדומים ללא מתאימה עבור מרוזואיטים של הגזע הקטלני Plasmodium falciparum. הדעה הרווחת היא כי זהו יתרון שרידותי סלקטיבי לחולים עם תכונות תלסמיות. בצורת השקפה זו התלסמיה דומה להפרעה גנטית אחרת, אנמיה חרמשית.
עדויות אפידמיולוגיות מקניה מצביעות על סיבה נוספת: הגנה נגד אנמיה חמורה עשויה להיות היתרון[8]. לאנשים המאובחנים בבטא תלסמיה הטרוזיגוטית (נשאים) יש הגנה מסוימת כנגד מחלת לב כלילית[9].
זכויות ילדים חולי תלסמיה
[עריכת קוד מקור | עריכה]בישראל ישנן זכויות שניתנים לילדים חולי תלסמיה.
- זכאים לקבל גמלת ילד נכה - הורים לילדים החולים במחלה וזקוקים לפחות אחת לחודש לעירוי דם/תחליפי דם/מוצרי דם.
- בקופות החולים, ילדים החולים במחלה זכאים לפטור והנחות משעותיות ברכישת תרופות ייעודיות למחלה. בכל קופה ההסדרים הם אחרים וכדאי לבדוק בכל קופה מה מגיע. חולי תלסמיה מוגדרים חולים כרוניים לפי משרד הבריאות וזכאים לתקרת מקסימום על הוצאות תרופות בסל. הוצאות מעל התקרה מחויבות בהחזר מצד הקופה. [10]
קישורים חיצוניים
[עריכת קוד מקור | עריכה]- על תלסמיה באתר StarMed
- תלסמיה באתר דוקטורס
- על תלסמיה באינפומד
- הרחבה באינפומד
- science/thalassemia-minor תלסמיה, באתר אנציקלופדיה בריטניקה (באנגלית)
 תלסמיה, דף שער בספרייה הלאומית
תלסמיה, דף שער בספרייה הלאומית
- Errant Gene Therapeutics - Caring for Orphan Diseases: Thalagen - Gene therapy treatment for beta Thalassemia
- Cooley's Anemia Foundation Leading the fight against thalassemia
- Northern Comprehensive Thalassemia Center: Provides information about the disease and related matters.
- Thalassemia Free Pakistan, A private charity foundation providing research material, and support for thalassemic patients and their families
- Thalassemia Overview (Latest Research)
- Thalassemia Patients and Friends: Message board for those affected.
- Thalforum.com - Thalassemia Community Forum: Thalassemia Discussion Forum for Thalassemia Patients, Families and Care-givers.
- Thalassemia Foundation of Canada:
- Hemoglobal A fully registered Canadian charity providing medical aid to Sri Lankan children with thalassemia.
- Thalassemia Support Foundation Helping Patients Find Hope
- Micrel Medical Devices Sells Iron-Chelation equipment for Thalassemia patients
הערות שוליים
[עריכת קוד מקור | עריכה]- ^ E. Goljan, Pathology, 2nd ed. Mosby Elsevier, Rapid Review Series
- ^ Kumar et al, eds. Robbins and Cotran's Pathologic Basis of Disease, 7th ed.
- ^ E. Goljan, Pathology, 2nd ed. Mosby Elsevier, Rapid Review series.
- ^ Maggio A, D'Amico G, et al. ,Deferiprone versus deferoxamine in patients with thalassemia major: a randomized clinical trial ,Blood Cells Mol Dis,year: 2002, volume: 28, issue: 2, pages: 196-208, PMID 12064916
- ^ Palma-Carlos AG, Palma-Carlos ML, Costa AC, "Minor" hemoglobinopathies: a risk factor for asthma ,journal: Allerg Immunol (Paris), year: 2005, volume: 37, issue: 5, pages: 177–82
- ^ Brodie BB, Heterozygous β-thalassaemia as a susceptibility factor in mood disorders: excessive prevalence in bipolar patients ,journal: Clin Pract Epidemiol Mental Health, year: 2005 ,volume: 1, pages: 6
- ^ Leung NT, Lau TK, Chung TKH, Thalassemia screening in pregnancy, journal: Curr Opinion in Ob Gyn, year: 2005, volume: 17
- ^ Wambua S, Mwangi TW, Kortok M, Uyoga SM, Macharia AW, Mwacharo JK, Weatherall DJ, Snow RW, Marsh K, Williams TN, title: The effect of α+-Thalassaemia on the Incidence of Malaria and other diseases in children living on the coast of Kenya, booktitle: PLoS Med 3(5): e158., year: 2006
- ^ l author: Tassiopoulos S,Deftereos S,Konstantopoulos K,Farmakis D,Tsironi M,Kyriakidis M,Aessopos A. , title: Does heterozygous beta-thalassemia confer a protection against coronary artery disease?, journal: Ann N Y Acad Sci., year: 2005, volume: 1053
- ^ תלסמיה באתר יולדת.
הבהרה: המידע בוויקיפדיה נועד להעשרה בלבד ואינו מהווה ייעוץ רפואי.
