Reaksi perisiklik

Dalam kimia organik, reaksi perisiklik adalah suatu jenis reaksi organik di mana keadaan transisi molekul memiliki suatu geometri siklik, dan reaksi berjalan secara serentak. Reaksi perisiklik biasanya merupakan suatu reaksi penataan ulang.
Secara umum, reaksi ini dianggap sebagai proses kesetimbangan, walaupun memungkinkan untuk mendorong reaksi dalam satu arah dengan merancang suatu reaksi di mana produk berada pada suatu tingkatan energi yang rendah secara signifikan; hal ini disebabkan oleh interpretasi unimolekular terhadap prinsip Le Chatelier.
Reaksi perisiklik terkadang memiliki keterkaitan dengan proses radikal. Beberapa reaksi perisiklik, seperti sikloadisi [2+2], 'kontroversial' karena mekanismenya tidak secara definitif diketahui serentak (atau mungkin bergantung pada sistem yang reaktif). Reaksi perisiklik juga sering memiliki analog dikatalisasi logam, walaupun biasanya ini juga tidak secara teknis perisiklik, karena mereka melanjutkan melalui zat antara yang distabilkan logam, dan dengan demikian tidak serentak.
Karakteristik
[sunting | sunting sumber]
Karakteristik yang membedakan reaksi perisiklik dengan reaksi lain adalah:[2]
- Reaksi relatif tidak mudah terpengaruh dengan perubahan pelarut, adanya inisiator radikal, atau (dengan beberapa pengecualian) oleh katalis elektrofilik atau nukleofilik.
- Reaksi melewati serangkaian peristiwa pemutusan ikatan dan pembuatan ikatan secara simultan (bersama) dalam satu langkah kinetik, seringkali dengan stereospesifikitas tinggi.
- Sesuai dengan 1 & 2, tidak ada ionik, radikal bebas atau zat antara lain yang dapat dilihat yang terletak pada jalur reaksi.
Tipe reaksi perisiklik
[sunting | sunting sumber]Kelas utama pada reaksi perisiklik diantaranya:
| Nama | Perubahan ikatan kimia | |
|---|---|---|
| Sigma | Pi | |
| Reaksi elektrosiklik | + 1 | -1 |
| Sikloadisi | +2 | -2 |
| Reaksi sigmatropik | 0 | 0 |
| Reaksi transfer gugus fungsional | + 1 | -1 |
| Reaksi keletropik | + 2 | - 2 |
| Reaksi diotropik | 0 | 0 |
Reaksi perisiklik dalam stereokimia
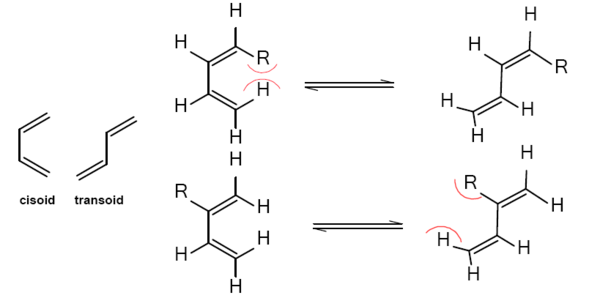
[sunting | sunting sumber]Sudah sangat diketahui bahwa diena hanya bisa masuk dalam reaksi sikloadisi dengan dienofil dalam bentuk cisoid dan laju reaksi dengan diena rantai terbuka bergantung pada proporsi keseimbangan dari konformer cisoid / transoid. Sehingga substituen di dalam diena secara signifikan dapat mempengaruhi laju reaksi tidak hanya karena karakter elektroniknya tetapi dengan pengaruhnya terhadap proporsi relatif dari konformer yang berbeda.
Karenanya pada contoh butadiena I tersubstitusi- cis I kurang reaktif dibanding trans isomer II nya karena meruahnya R tidak disukai pada konformasi cisoid. Substituen-2 yang meruah pada diena disukai oleh konformasi cisoid melebihi transoid sehingga diena dalam hal ini menjadi lebih reaktif.[3]
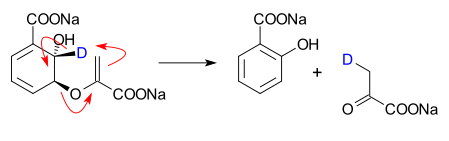
Aplikasi reaksi perisiklik pada Stereokimia dalam sikloadisi dari An Introduction to Orbital Symmetry and Pericyclic Reactions 2006 - Prof. Dr. Fathy Mohamed Abdelrazek
Reaksi perisiklik dalam biokimia
[sunting | sunting sumber]Reaksi perisiklik juga terdapat dalam beberapa proses biologis:
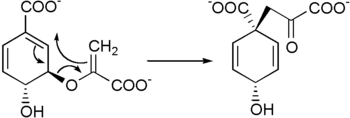
- Penataan ulang Claisen pada korismat menjadi prefenat di hampir semua organisme prototropik
- Pergeseran sigmatropik-[1,5] dalam transformasi precorrin-8x menjadi asam hidrogenobirinat
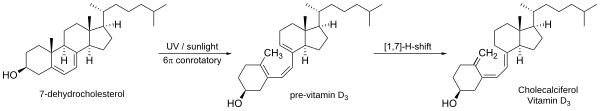
- Pembukaan cincin elektrosiklik[4] fotokimia, non-enzimatik, dan pergeseran hidrida sigmatropik (1,7) dalam sintesis vitamin D[5]
Lihat pula
[sunting | sunting sumber]Referensi
[sunting | sunting sumber]- ^ Huisgen, R. Kinetics and Mechanism of 1,3-Dipolar Cycloadditions. Angew. Chem. Int. Ed. Engl. 2, pp. 633-645 (1963)
- ^ Reusch, William. "Non-ionic Chemical Reactions". www2.chemistry.msu.edu (dalam bahasa Inggris). Diakses tanggal 2020-08-25.
- ^ An Introduction to Orbital Symmetry and Pericyclic Reactions 2006 - Prof. Dr. Fathy Mohamed Abdelrazek
- ^ Biosynthetic and Biomimetic Electrocyclizations. Chem. Rev., Volume 105, Issue 12, 2005, Pages 4757-4778 Christopher M. Beaudry, Jeremiah P. Malerich, and Dirk Trauner doi:10.1021/cr0406110
- ^ J. T. Arnason, Rachel Mata, John T. Romeo. Phytochemistry of Medicinal Plant (2nd Edition).1995 (Springer) ISBN 0-306-45181-6, ISBN 978-0-306-45181-2
- ^ Isochorismate Pyruvate Lyase: A Pericyclic Reaction Mechanism? Michael S. DeClue, Kim K. Baldridge, Dominik E. Künzler, Peter Kast, and Donald Hilvert J. Am. Chem. Soc.; 2005; 127(43) pp 15002 - 15003; (Communication) DOI:10.1021/ja055871t