硫化亜鉛
| 硫化亜鉛 | |
|---|---|
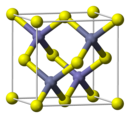  左は閃亜鉛鉱構造、右はウルツ鉱構造
| |
| IUPAC名 | 硫化亜鉛 |
| 組成式 | ZnS |
| 式量 | 97.48 g/mol |
| 形状 | 白色から黄色の結晶または粉末 |
| CAS登録番号 | 1314-98-3 |
| 密度と相 | 4.0 g/cm3, 固体 |
| 融点 | 1718 °C (1991 K) |
| 沸点 | 1180 °C(昇華) |
| 出典 | ICSC |
硫化亜鉛(りゅうかあえん、Zinc sulfide)は組成式 ZnS で表される共有結合性の化合物で、白または黄色の粉末または結晶である。普通はより安定な立方晶系型として存在し、これは閃亜鉛鉱として産出する。六方晶系型は合成によって得られるが、ウルツ鉱としても天然に存在する。閃亜鉛鉱とウルツ鉱はそれぞれ固有の大きなバンドギャップを持つ半導体である。300 ケルビンにおけるバンドギャップの値は、ウルツ鉱が3.91電子ボルト、閃亜鉛鉱が3.54電子ボルトである。
閃亜鉛鉱型からウルツ鉱型への結晶構造の転移は約1293ケルビンで起こる。閃亜鉛鉱型 ZnS の融点は1991ケルビンで、その298ケルビンにおける標準生成エンタルピーは −204.6 KJ/mol である。
製法
[編集]硫黄と亜鉛の直接化合、または亜鉛イオンを含む水溶液に硫化水素を吹き込むことで生成する。
用途
[編集]初期の原子物理学においてアーネスト・ラザフォードらはシンチレーターとして硫化亜鉛を用いた。これは硫化亜鉛がアルファ線やX線や電子線などといった放射線によって励起された際に発光するという性質を利用したもので、X線の増感剤や(陰極線=電子線を用いる)ブラウン管の材料としても有用であった。不純物が存在すると燐光を持つようになり、青色光または紫外線を発する。
ラザフォードらはとくに硫化亜鉛をアルファ線測定用のシンチレータとして利用した。もっとも、当時の技術では自動計測は難しかったため硫化亜鉛の粉末を用い、暗室にて目測で発光を数えアルファ線の数を数えていたが、測定者の集中力などの問題もありあまり活用できなかった。しかしながらアルファ線を物質に照射するラザフォード散乱の実験に応用し、原子核の存在を証明した[1]。なおアルファ線の検出用素子としては未だに有用である。
数ppm程度の活性剤を添加して発光体として用いられ、ブラウン管、X線スクリーンや暗所で光る部品(蓄光剤)など多くの用途を持つ。銀が活性剤として使われた場合、発する光は最長波長450ナノメートルの明るい青に、マンガンの場合は黄色になる。銅の場合は発光時間の長い、蓄光剤として良く知られる緑色っぽい色になる。銅をドーピングした硫化亜鉛 (ZnS:Cu) はエレクトロルミネセンスパネルなどにも用いられる。ZnS半導体は一時期青色発光ダイオードの有力候補となった時もあった。
赤外光用の光学素子としても使われ、可視光から12マイクロメートル以上の波長を透過する。平面状の光学窓やレンズの形で使用される。商標名としてCleartranやIrtran-2などがある。
ドーピングによりN型半導体とP型半導体の両方として使用することができるが、これはII-VI族半導体としては珍しい性質である。
脚注・出典
[編集]- ^ 三浦功・菅浩一・俣野恒夫、『放射線計測学第4版』、裳華房、〈物理学選書7〉、昭和40年7月5日、2頁。
関連項目
[編集]外部リンク
[編集]- VENATOR
- 蝶理株式会社無機ファイン部
- 国際化学物質安全性カード 硫化亜鉛 (ICSC:1627) 日本語版(国立医薬品食品衛生研究所による), 英語版
