피로인산염

| |
| |
| 이름 | |
|---|---|
| 별칭
diphosphate,
dipolyphosphate | |
| 식별자 | |
3D 모델 (JSmol)
|
|
| ChEBI | |
| ChemSpider | |
| DrugBank | |
| E 번호 | E450 (시그너, ...) |
| 26938 | |
PubChem CID
|
|
| UNII | |
| |
| |
| 성질 | |
| P 2O4− 7 | |
| 몰 질량 | 173.943 g·mol−1 |
| 짝산 | 피로인산 |
달리 명시된 경우를 제외하면, 표준상태(25 °C [77 °F], 100 kPa)에서 물질의 정보가 제공됨.
| |
피로인산염(영어: pyrophosphate)은 화학에서 P–O–P 결합에 2개의 인 원자를 포함하고 있는 인 산소 음이온이다. 피로인산 이나트륨(Na2H2P2O7) 및 피로인산 사나트륨(Na4P2O7)과 같은 많은 피로인산염들이 존재한다. 피로인산염은 종종 이인산염(영어: diphosphate)이라고도 불린다. 모체가 되는 피로인산염은 피로인산의 부분적 또는 완전한 중화로부터 유도된다. 피로인산 결합은 때때로 인산 무수물 결합이라고도 하며, 이는 2개의 인산염이 새로운 P–O–P 결합을 형성할 때 일어나는 탈수를 강조하는 명명 규칙이며, 이는 카복실산 무수물의 명명법을 반영한다. 피로인산은 생화학에서 매우 중요한 ATP 및 기타 뉴클레오사이드 삼인산에서 발견된다.
피로인산염은 인산염을 가열하여 제조되기 때문에 피로인산염이라는 이름(πῦρ, πυρός, 로마자 표기: pyr, pyros, 직역: "불(fire)")[1]이 되었다. 보다 정확하게는 인산을 축합 반응이 일어날 정도로 가열하여 생성한다.
피로인산염은 일반적으로 흰색 또는 무색이다. 알칼리 금속염은 수용성이다.[2] 이들은 금속 이온(칼슘 및 많은 전이 금속과 같은)에 대한 우수한 착화제이며 산업 화학에서 많이 사용된다. 피로인산염은 전체 폴리인산염 계열의 첫 번째 구성원이다.[3]
피로인산이라는 용어는 다이메틸알릴 피로인산과 같이 무기 인산과 인산화된 생물학적 화합물의 축합에 의해 형성되는 에스터의 이름이기도 하다. 이 결합은 고에너지 인산 결합이라고도 한다.
생화학에서
[편집]음이온 P
2O4−
7는 PPi로 약칭되며 무기 피로인산염(inorganic pyrophosphate)을 나타낸다. 피로인산은 세포에서 ATP가 AMP로 가수분해되어 형성된다.
- ATP → AMP + PPi
예를 들어 뉴클레오타이드가 중합효소에 의해 신장되는 DNA 또는 RNA 가닥에 첨가되면 피로인산(PPi)이 방출된다. 가피로인산분해(pyrophosphorolysis)는 피로인산이 3'-뉴클레오사이드 일인산(NMP 또는 dNMP)와 반응하는 중합반응의 역반응으로, 올리고뉴클레오타이드로부터 제거되는 상응하는 뉴클레오사이드 삼인산(DNA로부터 dNTP 또는 RNA로부터 NTP)를 방출한다.
피로인산 음이온은 P
2O4−
7의 구조를 가지며 인산염의 산 무수물이다. 피로인산 음이온은 수용액에서 불안정하며 무기 인산으로 가수분해된다.
- P
2O4−
7 + H2O → 2 HPO2−
4
또는 생물학자들의 약칭 표기법:
- PPi + H2O → 2 Pi + 2 H+
효소 촉매작용이 없는 경우 피로인산, 선형 삼인산, ADP, ATP와 같은 단순 폴리인산의 가수분해 반응은 일반적으로 매우 산성인 매질을 제외한 모든 매질에서 매우 느리게 진행된다.[4]
이 반응의 역반응은 인산염을 가열하여 피로인산염을 제조하는 방법이다.
무기 인산염으로의 이러한 가수분해는 ATP의 AMP와 PPi로의 분해를 비가역적인 반응으로 효과적으로 만들고, 이러한 가수분해와 결합된 생화학적 반응도 비가역적인 반응이 된다.
PPi는 활액, 혈장, 소변에서 석회화를 차단하기에 충분한 수준으로 생성되며, 세포외액에서 수산화인회석 형성의 천연 저해제일 수 있다.[5] 세포는 세포 내 PPi를 세포외액으로 전달할 수 있다.[6] ANK는 세포 외 PPi 수준을 지원하는 비효소적 막 PPi 통로이다.[6] 막 PPi 통로 ANK의 기능 결함은 낮은 세포 외 PPi 및 높은 세포 내 PPi와 관련이 있다.[5] 엑토뉴클레오타이드 피로포스파테이스/포스포다이에스터레이스(ENPP)는 세포 외 PPi를 높일 수 있는 기능을 가지고 있다.[6]
고에너지 인산 계산의 관점에서 ATP를 AMP와 PPi로 가수분해하려면 2개의 고에너지 인산이 필요하며, AMP를 ATP로 재구성하려면 2번의 인산화 반응이 필요하다.
무기 피로인산의 혈장 농도는 0.58–3.78 µM (95% 예측 구간)의 참조 범위이다.[7]
테르펜
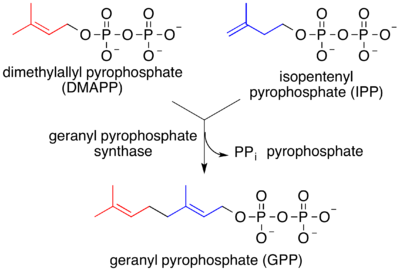
[편집]아이소펜테닐 피로인산은 수만 가지의 테르펜 및 테르페노이드의 전구체인 제라닐 피로인산으로 전환된다.[8]
 |
식품 첨가물
[편집]다양한 피로인산은 식품 가공에서 유화제, 안정제, 산도 조절제, 팽창제, 격리제 및 수분 보유제로 사용된다.[9] 이들은 E 번호 체계에서 E450으로 분류된다.[10]
- E450(a): 피로인산 이나트륨, 피로인산 삼나트륨, 피로인산 사나트륨(TSPP), 피로인산 사칼륨
- E450(b): 삼인산 오나트륨, 삼인산 오칼륨
- E450(c): 폴리인산 나트륨, 폴리인산 칼륨
특히 휘핑 크림을 안정화시키기 위해 다양한 피로인산 제형이 사용된다.[11]
같이 보기
[편집]각주
[편집]- ↑ Bailly, Anatole. “Greek-french dictionary online”. 《www.tabularium.be》. 2019년 3월 12일에 확인함.
- ↑ C.Michael Hogan. 2011. Phosphate. Encyclopedia of Earth. Topic ed. Andy Jorgensen. Ed.-in-Chief C.J.Cleveland. National Council for Science and the Environment. Washington DC
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1997). 《Chemistry of the Elements》 2판. Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ↑ Van Wazer JR, Griffith EJ, McCullough JF (Jan 1955). “Structure and Properties of the Condensed Phosphates. VII. Hydrolytic Degradation of Pyro- and Tripolyphosphate”. 《J. Am. Chem. Soc.》 77 (2): 287–291. doi:10.1021/ja01607a011.
- ↑ 가 나 Ho AM, Johnson MD, Kingsley DM (Jul 2000). “Role of the mouse ank gene in control of tissue calcification and arthritis”. 《Science》 289 (5477): 265–70. Bibcode:2000Sci...289..265H. doi:10.1126/science.289.5477.265. PMID 10894769.
- ↑ 가 나 다 Rutsch F, Vaingankar S, Johnson K, Goldfine I, Maddux B, Schauerte P, Kalhoff H, Sano K, Boisvert WA, Superti-Furga A, Terkeltaub R (Feb 2001). “PC-1 nucleoside triphosphate pyrophosphohydrolase deficiency in idiopathic infantile arterial calcification”. 《Am J Pathol》 158 (2): 543–54. doi:10.1016/S0002-9440(10)63996-X. PMC 1850320. PMID 11159191.
- ↑ Ryan LM, Kozin F, McCarty DJ (1979). “Quantification of human plasma inorganic pyrophosphate. I. Normal values in osteoarthritis and calcium pyrophosphate dihydrate crystal deposition disease”. 《Arthritis Rheum.》 22 (8): 886–91. doi:10.1002/art.1780220812. PMID 223577.
- ↑ Eberhard Breitmaier (2006). 〈Hemi‐ and Monoterpenes〉. 《Terpenes: Flavors, Fragrances, Pharmaca, Pheromones》. 10–23쪽. doi:10.1002/9783527609949.ch2. ISBN 9783527609949.
- ↑ Codex Alimentarius 1A, 2nd ed, 1995, pp. 71, 82, 91
- ↑ D. J. Jukes, Food Legislation of the UK: A Concise Guide, Elsevier, 2013, p. 60–61
- ↑ Ricardo A. Molins, Phosphates in Food, p. 115
더 읽을거리
[편집]- Schröder HC, Kurz L, Muller WE, Lorenz B (Mar 2000). “Polyphosphate in bone” (PDF). 《Biochemistry (Moscow)》 65 (3): 296–303. 2011년 8월 25일에 원본 문서 (PDF)에서 보존된 문서.
외부 링크
[편집] 위키미디어 공용에 피로인산염 관련 미디어 분류가 있습니다.
위키미디어 공용에 피로인산염 관련 미디어 분류가 있습니다.- 의학주제표목 (MeSH)의 Pyrophosphates
