Bahan uji Grignard

Bahan uji Grignard atau sebatian Grignard ialah sebatian kimia dengan formula am R−Mg−X, dengan X ialah halogen dan R ialah kumpulan organik, biasanya kumpulan berfungsi alkil atau aril. Dua contoh biasa ialah metilmagnesium klorida Cl−Mg−CH
3 dan fenilmagnesium bromida (C
6H
5)−Mg−Br. Mereka adalah subkelas sebatian organomagnesium .
Sebatian Grignard ialah reagen popular dalam sintesis organik untuk mencipta ikatan karbon-karbon baharu. Contohnya, apabila bertindak balas dengan sebatian halogen lain R'−X' dengan kehadiran mangkin yang sesuai, ia biasanya menghasilkan R−R' dan magnesium halida MgXX' sebagai hasil sampingan; dan magnesium halida tidak larut dalam pelarut yang biasa digunakan. Dalam aspek ini, mereka serupa dengan reagen organolitium.
Bahan uji Grignard yang tulen adalah pepejal yang sangat reaktif. Ia biasanya dikendalikan sebagai larutan dalam pelarut seperti dietil eter atau tetrahydrofuran; yang agak stabil selagi tiada air dalam persekitaran. Dalam medium sedemikian, bahan uji Grignard sentiasa hadir sebagai kompleks dengan atom magnesium disambungkan kepada dua oksigen eter melalui ikatan koordinasi.
Penemuan tindak balas Grignard pada tahun 1900 telah dianugerahkan dengan Hadiah Nobel pada tahun 1912. Untuk butiran lanjut tentang sejarah, lihat Victor Grignard.
Sintesis
[sunting | sunting sumber]Daripada logam Mg
[sunting | sunting sumber]Bahan uji Grignard secara tradisionalnya dihasilkan melalui tindak balas halida organik (biasanya organobromin) dengan logam magnesium. Eter diperlukan untuk menstabilkan sebatian organomagnesium. Air dan udara, yang memusnahkan sebatian dengan cepat melalui protonolisis atau pengoksidaan, dikecualikan menggunakan teknik bebas udara. [1] Walaupun sebatian masih perlu kering, penggunaan teknuk ultrabunyi boleh membenarkan bahan uji Grignard terbentuk dalam pelarut basah dengan mengaktifkan magnesium supaya ia menggunakan air.[2]
Sebuah tindak balas kimia yang biasa akan melibatkan pepejal dan larutan, tetapu pembentukan bahan uji Grignard selalunya tertakluk kepada tempoh aruhan. Semasa di peringkat ini, oksida pasif pada magnesium dikeluarkan. Selepas tempoh induksi ini, tindak balas boleh menjadi sangat eksotermik. Sifat eksotermik ini mesti dipertimbangkan apabila tindak balas ditingkatkan dari makmal ke kilang pengeluaran. [3] Kebanyakan organolid akan berfungsi, tetapi ikatan karbon-fluorin secara amnya tidak reaktif, kecuali dengan magnesium yang diaktifkan khas (melalui logam Rieke).
Magnesium
[sunting | sunting sumber]Lazimnya tindak balas untuk membentuk reagen Grignard melibatkan penggunaan reben magnesium. Semua magnesium disalut dengan lapisan pasif magnesium oksida, yang menghalang tindak balas dengan halida organik. Pelbagai kaedah telah dibangunkan untuk melemahkan lapisan pasif ini, melalui cara mendedahkan magnesium yang sangat reaktif kepada halida organik. Kaedah mekanikal termasuk penghancuran kepingan Mg in situ, kacauan pantas, dan kaedah sonikasi. [4] Iodin, metil iodida, dan 1,2-dibromoetana adalah agen pengaktifan biasa. Penggunaan 1,2-dibromoetana adalah berfaedah kerana tindakannya boleh dipantau dengan pemerhatian gelembung etilena. Tambahan pula, produk sampingan tidak berbahaya:
- Mg + BrC2 H4Br → C2H4 + MgBr2
Jumlah Mg yang digunakan oleh agen pengaktif ini biasanya tidaklah banyak. Sebilangan kecil merkuri klorida akan menggabungkan permukaan logam, meningkatkan kereaktifannya. Penambahan bahan uji Grignard prabentuk sering digunakan sebagai pemula.
Magnesium yang diaktifkan khas, seperti Rieke magnesium, mengelakkan masalah ini.[5] Lapisan oksida juga boleh dipecahkan menggunakan kaedah ultrabunyi, menggunakan batang kacau untuk menggaru lapisan teroksida,[6] atau dengan menambah beberapa titik iodin atau 1,2-Diiodoethane. Pilihan lain ialah menggunakan magnesium tersublim atau magnesium antrasena. [7]
Mekanisme
[sunting | sunting sumber]Dari segi mekanisme, tindak balas berlaku melalui pemindahan elektron tunggal: [8] [9] [10]
- R−X + Mg → R−X •− + Mg •+
- R−X •− → R • + X −
- R • + Mg •+ → RMg +
- RMg + + X − → RMgX
Tindak balas pemindahan Mg (pertukaran halogen–Mg)
[sunting | sunting sumber]Penyediaan alternatif reagen Grignard melibatkan pemindahan Mg daripada reagen Grignard yang telah terbentuk sebelumnya kepada halida organik. Reagen organomagnesium yang lain juga boleh digunakan.[11] Kaedah ini menawarkan kelebihan bahawa pemindahan Mg bertolak ansur dengan pelbagai jenis kumpulan berfungsi. Tindak balas ilustrasi melibatkan isopropilmagnesium klorida dan aril bromida atau iodida: [12]
- i -PrMgCl + ArCl → i -PrCl + ArMgCl
Daripada sebatian alkilzink ( transmetalasi reduktif)
[sunting | sunting sumber]Salah satu kaedah untuk sintesis reagen Grignard melibatkan tindak balas Mg dengan sebatian organozink. Kaedah ini telah digunakan untuk membuat reagen Grignard berasaskan adamantane, yang disebabkan oleh tindak balas sampingan gandingan C-C, sukar dibuat dengan kaedah konvensional daripada alkil halida dan Mg. Transmetalasi reduktif terbentuk melalui tindak balas ini: [13]
- AdZnBr + Mg → AdMgBr + Zn
Menguji bahan uji Grignard
[sunting | sunting sumber]Oleh kerana bahan uji Grignard sangat sensitif terhadap lembapan dan oksigen, banyak kaedah telah dibangunkan untuk menguji kualiti kumpulan. Ujian biasa melibatkan pentitratan dengan reagen protik kontang boleh ditimbang, contohnya mentol dengan kehadiran penunjuk warna. Interaksi bahan uji Grignard dengan phenanthroline atau 2,2'-biquinoline akan mengakibatkan perubahan warna.[14]
Tindak balas bahan uji Grignard
[sunting | sunting sumber]Dengan sebatian karbonil
[sunting | sunting sumber]Bahan uji Grignard bertindak balas dengan pelbagai derivatif karbonil .
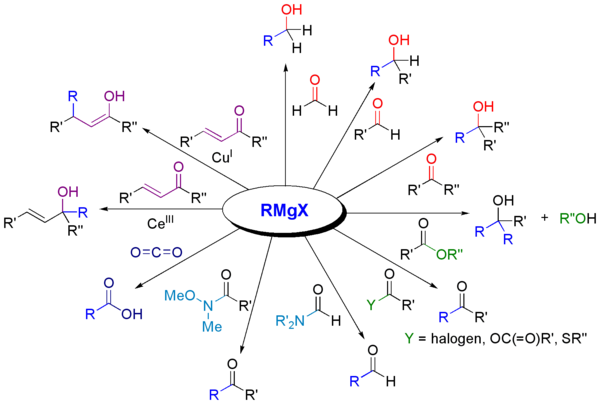
Penggunaan bahan uji Grignard yang paling biasa ialah dalam proses alkilasi aldehid dan keton, iaitu tindak balas Grignard: [15]

Satu perkara yang perlu dimaklumkan ialah fungsi asetal (karbonil terlindung) tidak bertindak balas di dalam tindak balas tersebut.
Tindak balas sedemikian biasanya melibatkan kerja berasid berair, walaupun langkah ini jarang ditunjukkan dalam skema tindak balas. Dalam kes di mana bahan uji Grignard menambah kepada aldehid atau keton prochiral, model Felkin-Anh atau Peraturan Cram biasanya boleh meramalkan stereoisomer yang akan terbentuk. Dengan terbentuknya 1,3- diketon yang mudah dinyahproton dan substrat berasid yang berkaitan, bahan uji Grignard RMgX hanya berfungsi sebagai bes, memberikan anion enolat dan membebaskan alkana RH.
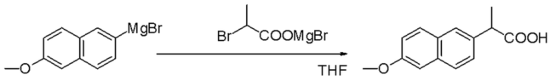
Bahan uji Grignard ialah nukleofil dalam penggantian alifatik nukleofilik contohnya dengan alkil halida dalam langkah utama dalam pengeluaran Naproxen perindustrian:
Tindak balas sebagai bes
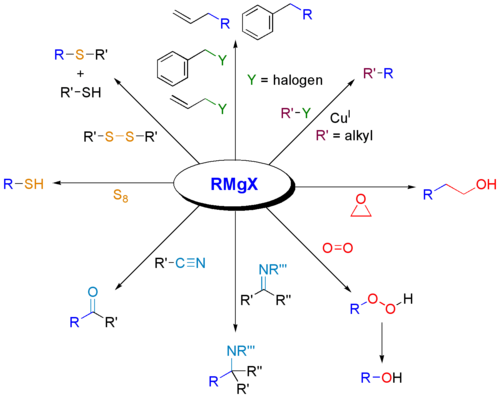
[sunting | sunting sumber]Bahan uji Grignard berfungsi sebagai bes untuk substrat protik (skim ini tidak menunjukkan keadaan kerja, yang biasanya termasuk air). Bahan uji Grignard adalah bes dan bertindak balas dengan alkohol, fenol, dll. untuk memberikan alkoksida (ROMgBr). Terbitan fenoksida mudah terdedah kepada pembentukan oleh paraformaldehid untuk menghasilkan salisiladehid.[16]
Alkilasi logam dan metaloid
[sunting | sunting sumber]Seperti sebatian organolitium, bahan uji Grignard berguna untuk membentuk ikatan karbon-heteroatom.
Bahan uji Grignard bertindak balas dengan banyak elektrofil yang berasaskan logam. Sebagai contoh, mereka menjalani transmetallation dengan kadmium klorida (CdCl2) untuk memberikan dialkylcadmium : [17]
- 2 RMgX + CdCl2 → R2Cd + 2 Mg(X)Cl
Keseimbangan Schlenk
[sunting | sunting sumber]Kebanyakan tindak balas Grignard dijalankan dalam pelarut halus, terutamanya dietil eter dan THF. Bahan uji Grignard bertindak balas dengan 1,4-dioksana untuk memberikan sebatian diorganomagnesium dan polimer koordinasi tidak larut MgX2(dioksana)2 dan (R = kumpulan organik, X = halida):
- 2 RMgX + dioksana ⇌ R2Mg + MgX2(dioksana)2
Tindak balas ini mengeksploitasi keseimbangan Schlenk, memacunya ke arah kanan di dalam persamaan tadi.
Prekursor kepada magnesiat
[sunting | sunting sumber]Bahan uji Grignard bertindak balas dengan sebatian organolitium untuk memberikan kompleks makan (Bu = butyl): [18]
- BuMgBr + 3 BuLi → LiMgBu3 + BuBr
Gandingan dengan halida organik
[sunting | sunting sumber]Bahan uji Grignard biasanya tidak bertindak balas dengan halida organik, berbeza dengan kereaktifan tinggi mereka dengan halida kumpulan utama yang lain. Walau bagaimanapun, dengan kehadiran pemangkin logam, bahan uji Grignard mengambil bahagian dalam tindak balas gandingan C-C. Sebagai contoh, nonylmagnesium bromide bertindak balas dengan metil p-chlorobenzoate untuk memberikan asid p-nonylbenzoik, dengan kehadiran Tris(acetylacetonato)ferum(III) (Fe(acac)3), selepas bekerja dengan NaOH untuk menghidrolisis ester, ditunjukkan seperti berikut. . Tanpa Fe(acac)3, reagen Grignard akan menyerang kumpulan ester ke atas aril halida.
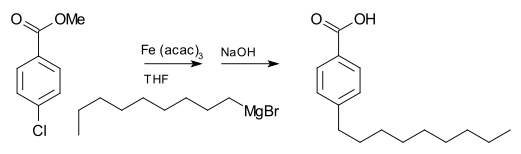
Untuk gandingan aril halida dengan bahan uji aril Grignard, nikel klorida dalam tetrahydrofuran (THF) juga merupakan pemangkin yang baik. Selain itu, pemangkin berkesan untuk gandingan alkil halida ialah mangkin Gilman litium tetraklorokurat (Li2CuCl4), disediakan dengan mencampurkan litium klorida (LiCl) dan kuprum(II) klorida (CuCl2) dalam THF. Gandingan Kumada-Corriu memberikan akses kepada stirena [digantikan] .
Pengoksidaan
[sunting | sunting sumber]Rawatan bahan uji Grignard dengan oksigen memberikan organoperoksida magnesium. Hidrolisis bahan ini menghasilkan hidroperoksida atau alkohol. Tindak balas ini melibatkan perantaraan radikal .
Pengoksidaan mudah bahan uji Grignard untuk memberikan alkohol adalah sedikit kepentingan praktikal kerana hasil umumnya lemah. Sebaliknya, urutan dua langkah melalui borane (vide supra) yang kemudiannya dioksidakan kepada alkohol dengan hidrogen peroksida adalah kegunaan sintetik.
Utiliti sintetik pengoksidaan Grignard boleh ditingkatkan dengan tindak balas bahan uji Grignard dengan oksigen dengan kehadiran alkena kepada alkohol lanjutan etilena.[19] Pengubahsuaian ini memerlukan aril atau vinil Grignards. Menambah hanya Grignard dan alkena tidak menghasilkan tindak balas yang menunjukkan bahawa kehadiran oksigen adalah penting. Satu-satunya kelemahan ialah keperluan sekurang-kurangnya dua setara Grignard walaupun ini sebahagiannya boleh dielakkan dengan penggunaan sistem dwi Grignard dengan Grignard penurun murah seperti n-butilmagnesium bromida.
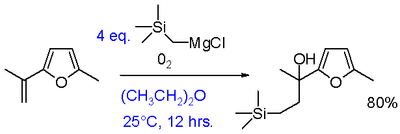
Penghapusan
[sunting | sunting sumber]Dalam sintesis olefin Boord, penambahan magnesium kepada β-haloeter tertentu boleh menghasilkan tindak balas penyingkiran kepada alkena. Tindak balas ini boleh mengehadkan kegunaan tindak balas bahan uji Grignard.
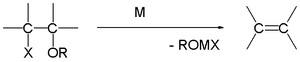
Kegunaan industri
[sunting | sunting sumber]Contoh tindak balas Grignard ialah langkah utama dalam pengeluaran industri (bukan stereoselektif) Tamoxifen[20] (kini digunakan untuk rawatan kanser payudara wanita yang menyasarkan reseptor estrogen positif): [21]
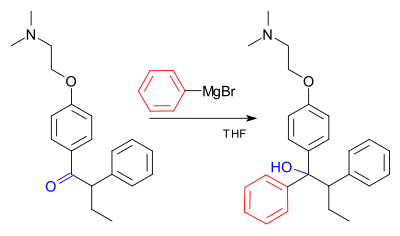
Lihat juga
[sunting | sunting sumber]- Dibutylmagnesium
- Hauser base
Galeri
[sunting | sunting sumber]-
Bahan magnesium diletakkan di dalam kelalang.
-
Tetrahydrofuran dan sejumlah kecil iodin ditambah.
-
Larutan alkil bromida ditambah semasa pemanasan.
-
Selepas selesai penambahan, adunan dipanaskan seketika.
-
Pembentukan bahan uji Grignard selesai. Sebilangan kecil magnesium masih kekal di dalam kelalang.
-
Bahan uji Grignard yang disediakan dengan itu disejukkan kepada 0°C sebelum penambahan sebatian karbonil. Larutan menjadi keruh apabila bahan uji Grignard mula termendak.
-
Larutan sebatian karbonil ditambah kepada bahan uji Grignard.
-
Penyelesaian dipanaskan pada suhu bilik. Pada ketika ini tindak dikira telah balas selesai.
Rujukan
[sunting | sunting sumber]- ^ Goebel, M. T.; Marvel, C. S. (1933). "The Oxidation of Grignard Reagents". Journal of the American Chemical Society. 55 (4): 1693–1696. doi:10.1021/ja01331a065.
- ^ Smith, David H. (1999). "Grignard Reactions in "Wet" Ether". Journal of Chemical Education. 76 (10): 1427. Bibcode:1999JChEd..76.1427S. doi:10.1021/ed076p1427.
- ^ Philip E. Rakita (1996). "5. Safe Handling Practices of Industrial Scale Grignard Ragents" (Google Books excerpt). Dalam Gary S. Silverman; Philip E. Rakita (penyunting). Handbook of Grignard reagents. CRC Press. m/s. 79–88. ISBN 0-8247-9545-8.
- ^ Smith, David H. (1999). "Grignard Reactions in "Wet" Ether". Journal of Chemical Education. 76 (10): 1427. Bibcode:1999JChEd..76.1427S. doi:10.1021/ed076p1427.
- ^ Lai Yee Hing (1981). "Grignard Reagents from Chemically Activated Magnesium". Synthesis. 1981 (9): 585–604. doi:10.1055/s-1981-29537.
- ^ Clayden, Jonathan; Greeves, Nick (2005). Organic chemistry. Oxford: Oxford Univ. Press. m/s. 212. ISBN 978-0-19-850346-0.
- ^ Wakefield, Basil J. (1995). Organomagnesium Methods in Organic Chemistry. Academic Press. m/s. 21–25. ISBN 0080538177.
- ^ Garst, J. F.; Ungvary, F. "Mechanism of Grignard reagent formation". In Grignard Reagents; Richey, R. S., Ed.; John Wiley & Sons: New York, 2000; pp 185–275. ISBN 0-471-99908-3.
- ^ Advanced Organic chemistry Part B: Reactions and Synthesis F.A. Carey, R.J. Sundberg 2nd Ed. 1983. Page 435
- ^ Garst, J.F.; Soriaga, M.P. "Grignard reagent Formation", Coord. Chem. Rev. 2004, 248, 623 - 652. doi:10.1016/j.ccr.2004.02.018.
- ^ Arredondo, Juan D.; Li, Hongmei; Balsells, Jaume (2012). "Preparation of t-Butyl-3-Bromo-5-Formylbenzoate Through Selective Metal-Halogen Exchange Reactions". Organic Syntheses. 89: 460. doi:10.15227/orgsyn.089.0460.
- ^ Knochel, P.; Dohle, W.; Gommermann, N.; Kneisel, F. F.; Kopp, F.; Korn, T.; Sapountzis, I.; Vu, V. A. (2003). "Highly Functionalized Organomagnesium Reagents Prepared through Halogen–Metal Exchange". Angewandte Chemie International Edition. 42 (36): 4302–4320. doi:10.1002/anie.200300579. PMID 14502700.
- ^ Armstrong, D.; Taullaj, F.; Singh, K.; Mirabi, B.; Lough, A. J.; Fekl, U. (2017). "Adamantyl Metal Complexes: New Routes to Adamantyl Anions and New Transmetallations". Dalton Transactions. 46 (19): 6212–6217. doi:10.1039/C7DT00428A. PMID 28443859.
- ^ Krasovskiy, Arkady; Knochel, Paul (2006). "Convenient Titration Method for Organometallic Zinc, Harshal ady Magnesium, and Lanthanide Reagents". Synthesis. 2006 (5): 890–891. doi:10.1055/s-2006-926345.
- ^ Haugan, Jarle André; Songe, Pål; Rømming, Christian; Rise, Frode; Hartshorn, Michael P.; Merchán, Manuela; Robinson, Ward T.; Roos, Björn O.; Vallance, Claire (1997). "Total Synthesis of C31-Methyl Ketone Apocarotenoids 2: The First Total Synthesis of (3R)-Triophaxanthin" (PDF). Acta Chemica Scandinavica. 51: 1096–1103. doi:10.3891/acta.chem.scand.51-1096. Dicapai pada 2009-11-26.
- ^ Peters, D. G.; Ji, C. (2006). "A Multistep Synthesis for an Advanced Undergraduate Organic Chemistry Laboratory". Journal of Chemical Education. 83 (2): 290. Bibcode:2006JChEd..83..290P. doi:10.1021/ed083p290.
- ^ "Unit 12 Aldehydes, Ketones and Carboxylic Acids" (PDF). Chemistry Part II Textbook for class XII. 2. India: National Council of Educational Research and Training. 2010. m/s. 355. ISBN 978-81-7450-716-7. Diarkibkan daripada yang asal (PDF) pada 2018-09-20. Dicapai pada 2019-03-09.
- ^ Arredondo, Juan D.; Li, Hongmei; Balsells, Jaume (2012). "Preparation of t-Butyl-3-Bromo-5-Formylbenzoate Through Selective Metal-Halogen Exchange Reactions". Organic Syntheses. 89: 460. doi:10.15227/orgsyn.089.0460.
- ^ Youhei Nobe; Kyohei Arayama; Hirokazu Urabe (2005). "Air-Assisted Addition of Grignard Reagents to Olefins. A Simple Protocol for a Three-Component Coupling Process Yielding Alcohols". J. Am. Chem. Soc. 127 (51): 18006–18007. doi:10.1021/ja055732b. PMID 16366543.
- ^ Richey, Herman Glenn (2000). Grignard Reagents: New Developments. Wiley. ISBN 0471999083.
- ^ Jordan VC (1993). "Fourteenth Gaddum Memorial Lecture. A current view of tamoxifen for the treatment and prevention of breast cancer". Br J Pharmacol. 110 (2): 507–17. doi:10.1111/j.1476-5381.1993.tb13840.x. PMC 2175926. PMID 8242225.
Bacaan lanjutan
[sunting | sunting sumber]- ned. by Gary S. Silverman .... (1996). Rakita, Philip E.; Silverman, Gary (penyunting). Handbook of Grignard Reagents. New York, N.Y: Marcel Dekker. ISBN 0-8247-9545-8.CS1 maint: extra text: authors list (link)
- Mary McHale, "Grignard Reaction," Connexions, http://cnx.org/content/m15245/1.2/. 2007.
- Grignard knowledge: Alkyl coupling chemistry with inexpensive transition metals by Larry J. Westrum, Fine Chemistry November/December 2002, pp. 10–13 [1]
Kepustakaan literatur khusus
[sunting | sunting sumber]- Rogers, H. R.; Hill, C. L.; Fujiwara, Y.; Rogers, R. J.; Mitchell, H. L.; Whitesides, G. M. (1980). "Mechanism of formation of Grignard reagents. Kinetics of reaction of alkyl halides in diethyl ether with magnesium". Journal of the American Chemical Society. 102 (1): 217. doi:10.1021/ja00521a034.
- De Boer, H.J.R.; Akkerman, O.S; Bickelhaupt, F. (1988). "Carbanions as intermediates in the synthesis of Grignard Reagents". Angew. Chem. Int. Ed. 27 (5): 687–89. doi:10.1002/anie.198806871.
- Van Klink, G.P.M.; de Boer, H.J.R; Schat, G.; Akkerman, O.S.; Bickelhaupt, F.; Spek, A. (2002). "Carbanions as Intermediates in the Formation of Grignard Reagents". Organometallics. 21 (10): 2119–35. doi:10.1021/om011083a.
|hdl-access=requires|hdl=(bantuan) - Shao, Y.; Liu, Z.; Huang, P.; Liu, B. (2018). "A unified model of Grignard reagent formation". Physical Chemistry Chemical Physics. 20 (16): 11100–08. Bibcode:2018PCCP...2011100S. doi:10.1039/c8cp01031e. PMID 29620768.

![Reactions of Grignard reagents with non carbon electrophiles {\displaystyle {\begin{matrix}{\ce {R4B-}}\\{\color {White}\scriptstyle {\ce {Et2O.BF3\ or\ NaBF4}}}{\Bigg \uparrow }\scriptstyle {\ce {Et2O.BF3\ or\ NaBF4}}\\{\ce {Ph2PR<-[{\ce {Ph2PCl}}]RMgX->[{\ce {Bu3SnCl}}]Bu3SnR}}\\{\color {White}\scriptstyle {\ce {B(OMe)3}}}{\Bigg \downarrow }\scriptstyle {\ce {B(OMe)3}}\\{\ce {RB(OMe)2}}\end{matrix}}}](http://178.128.105.246/cars-https-wikimedia.org/api/rest_v1/media/math/render/svg/e437b60e37160b69a20e287dba0820ae949a6a4d)








