Sulfur heksafluorida
Penampilan
| |||
| |||
| Nama | |||
|---|---|---|---|
| Nama IUPAC
Sulfur heksafluorida
| |||
| Nama IUPAC sistematik
Hexafluoro-λ6-sulfane[1] | |||
| Nama lain
Elagas
Esaflon | |||
| Sifat | |||
| F6S | |||
| Jisim molar | 146.05 g·mol−1 | ||
| Rupa bentuk | Tanpa warna, gas tidak berbau | ||
| Ketumpatan | 6.17 g/L | ||
| Takat didih | −64 °C; −83 °F; 209 K | ||
| Keterlarutan | agak larut di dalam air, sangat larut di dalam etanol, heksana, benzena | ||
| Tekanan wap | 2.9 MPa (pada 21.1 °C) | ||
| Struktur | |||
| Struktur kristal | Ortorombik, oP28 | ||
| Kumpulan ruang | Oh | ||
| Geometri koordinasi |
Heksagonal ortogonal | ||
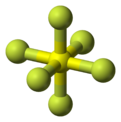
| Bentuk molekul | Oktahedral | ||
| Momen dwikutub | 0 D | ||
| Termokimia | |||
| Entropi molar piawai S |
292 J·mol−1·K−1[2] | ||
Entalpi pembentukan
piawai (ΔfH⦵298) |
−1209 kJ·mol−1[2] | ||
| Bahaya | |||
| Frasa S | S38 | ||
| NFPA 704 (berlian api) | |||
| Sebatian berkaitan | |||
Kecuali jika dinyatakan sebaliknya, data diberikan untuk bahan-bahan dalam keadaan piawainya (pada 25 °C [77 °F], 100 kPa). | |||
| | |||
| Rujukan kotak info | |||
Sulfur heksafluorida (SF6) ialah suatu gas rumah hijau tidak organik, tanpa warna, tidak berbau, tidak mudah bakar, dan sangat poten yang merupakan penebat elektrik bagus.[3] SF6 mempunyai geometri oktahedron, terdiri daripada enam atom fluorin tersambung dengan satu atom sulfur pusat. Sebatian ini merupakan molekul hipervalen. Tipikal untuk gas tidak berkutub, sebatian ini sangat kurang larut di dalam air tetapi larut di dalam pelarut organik tidak berkutub. Sebatian ini pada amnya diangkut sebagai gas mampat cecair. Sebatian ini mempunyai ketumpatan 6.12 g/L pada aras laut, yang ketara lebih tinggi daripada ketumpatan udara (1.225 g/L).
Lihat juga
[sunting | sunting sumber]- Selenium heksafluorida
- Telurium heksafluorida
- Molekul hipervalen
- Proses untuk Pengukuran Degradasi Sulfur Heksafluorida dalam Sistem Voltan Tinggi U.S. Patent 4,633,082
- Halokarbon—satu lagi kumpulan gas rumah hijau utama
Rujukan
[sunting | sunting sumber]- ^ "Sulfur Hexafluoride - PubChem Public Chemical Database". The PubChem Project. Pusat Negara untuk Maklumat Bioteknologi. Dicapai pada 22 Februari 2013.
- ^ a b Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. m/s. A23. ISBN 0-618-94690-X.
- ^ Ralat petik: Tag
<ref>tidak sah; tiada teks disediakan bagi rujukan yang bernamaNYT61313
Bacaan lanjut
[sunting | sunting sumber]- Gaseous Dielectrics VI. Plenum Press. 1991. ISBN 0-306-43894-1. Unknown parameter
|editors=ignored (bantuan) - Holleman, A. F.; Wiberg, E. Inorganic Chemistry Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- Khalifa, Mohammad (1990). High-Voltage Engineering: Theory and Practice. New York: Marcel Dekker. ISBN 0-8247-8128-7. OCLC 20595838.
- Maller, V. N.; Naidu, M. S. (1981). Advantages in High Voltage Insulation and Arc Interruption in SF6 and Vacuum. Oxford; New York: Pergamon Press. ISBN 0-08-024726-1. OCLC 7866855.
- SF6 Reduction Partnership for Electric Power Systems
Pautan luar
[sunting | sunting sumber]- Fluoride and compounds fact sheet Diarkibkan 2006-01-16 di Wayback Machine— Inventori Bahan Pencemar Negara
- High GWP Gases and Climate Change daripada tapak web EPA
- International Conference on SF6 and the Environment (arkib berkaitan)
- CDC - NIOSH Pocket Guide to Chemical Hazards
Templat:Heksafluorida Templat:Media kontras Templat:Sebatian sulfur



