Hydroxámová kyselina

Hydroxámové kyseliny sú deriváty karboxylových kyselín so všeobecným vzorcom R1C(=O)N(R2)OH, kde často R2 = H.[1] Sú to amidy, v ktorých je na dusíkový atóm naviazaná hydroxylová skupina. Často sa používajú ako chelačné činidlá.[2]
Príprava
[upraviť | upraviť zdroj]Hydroxámové kyseliny sa zvyčajne pripravujú z esterov alebo acylchloridov reakciami s hydroxylamínovými soľami. Syntéza kyseliny benzohydroxámovej prebieha napríklad podľa nasledujúcej rovnice:[3]
- C6H5CO2Me + NH2OH → C6H5C(O)NHOH + MeOH
Tieto kyseliny takisto možno pripraviť z aldehydov a N-sulfonylhydroxylamínov pomocou Angeliho-Riminiho reakcie.[4]
Reaktivita
[upraviť | upraviť zdroj]Známou reakciou esterov hydroxámových kyselín je Lossenovo odbúravanie,[5][6] kedy dochádza k ich premene na izokyanát.
Koordinačná chémia a biochémia
[upraviť | upraviť zdroj]Konjugované zásady hydroxámových kyselín sa nazývajú hydroxamáty. K deprotonácii dochádza na hydroxylovej skupine (NOH). Vzniknutá konjugovaná zásada je potom schopná tvoriť komplex s kovmi, pričom vystupuje ako chelačné činidlo s dvoma atómami kyslíku. Mnohé hydroxámové kyseliny a hydroxamáty viazané so železom boli izolované z prírodných zdrojov.[7]
Hydroxamáty bežne viažu ióny železa.[8] V prírode sa vyvinuli rôzne rodiny hydroxámových kyselín, ktoré fungujú ako zlúčeniny viažuce železo, ktoré sa nazývajú siderofóry. Extrahujú železité ióny z inak nerozpustných zdrojov (hrdza, minerály a iné). Vzniknuté komplexy sa prenášajú do bunky, kde sa z nich získava železa, ktoré sa potom používa v metabolizme.[9]
Ligandy odvodené od hydroxámových a tiohydroxámových kyselín tvoria silné komplexy i s olovnatými iónmi.[10]
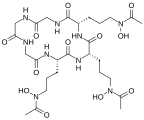
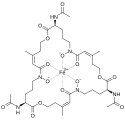
- Príklady siderofórov
-
Želetizý komplex triacetylfusarinínu[11]
Výskyt a použitie
[upraviť | upraviť zdroj]Hydroxámové kyseliny sa používajú vo flotácii kovov vzácnych zemín počas koncentrácie a extrakcie rúd, ktoré sa majú podrobiť ďalšiemu spracovaniu.[12][13]
Niektoré hydroxámové kyseliny (napr. vorinostat, belinostat, panobinostat a trichostatín A) sú inhibítory HDAC s protirakovinovými účinkami. Fosmidomycín je prírodný inhibítor DXP reduktoizomerázy (1-deoxy-D-xylulose-5-fosfátreduktoizomerázy).[chýba zdroj]
Hydroxámové kyseliny boli skúmané i v rámci spracovania použitého nukleárneho paliva.[chýba zdroj]
Referencie
[upraviť | upraviť zdroj]- ↑ hydroxámové kyseliny. In: BÍNA, Jaroslav. Malá encyklopédia chémie. Bratislava : Obzor, 1981. S. 308.
- ↑ MUNSON, James W.. Acid Derivatives (1992), Volume 2. Ed. S. Patai. [s.l.] : [s.n.], 1992. ISBN 9780470772508. DOI:10.1002/9780470772508.ch15 Hydroxamic acids, s. 849–873.
- ↑ Benzohydroxamic Acid. Org. Synth., 1939, s. 15. DOI: 10.15227/orgsyn.019.0015.
- ↑ LI, Jie Jack. Name Reactions: A Collection of Detailed Reaction Mechanisms. 2nd. vyd. Berlin, Heidelberg, New York : Springer, 2003. ISBN 978-3-662-05338-6. S. 9.
- ↑ WANG, Zerong. Comprehensive organic name reactions and reagents. [s.l.] : John Wiley & Sons, Inc., 2010. ISBN 9780471704508. S. 1772–1776.
- ↑ LITERÁK, Jaromír. Příklady ke Speciálnímu semináři z organické chemie II [online]. Masarykova Univerzita, Přírodovědecká fakulta, [cit. 2023-05-23]. Dostupné online.
- ↑ Abraham Shanzer, Clifford E. Felder, Yaniv Barda. The Chemistry of Hydroxylamines, Oximes and Hydroxamic Acids. Ed. Zvi Rappoport, Joel F. Liebman. [s.l.] : [s.n.], 2008. ISBN 9780470512616. DOI:10.1002/9780470741962.ch16 Natural and Biomimetic Hydroxamic Acid based Siderophores, s. 751–815.
- ↑ AGRAWAL, Y K. Hydroxamic Acids and Their Metal Complexes. Russian Chemical Reviews, 1979, s. 948–963. DOI: 10.1070/RC1979v048n10ABEH002422.
- ↑ MILLER, Marvin J.. Syntheses and Therapeutic Potential of Hydroxamic Acid Based Siderophores and Analogues. Chemical Reviews, November 1989, s. 1563–1579. DOI: 10.1021/cr00097a011.
- ↑ FARKAS, Etelka; BUGLYÓ, Péter. Lead: Its Effects on Environment and Health. [s.l.] : de Gruyter, 2017. ISBN 9783110434330. DOI:10.1515/9783110434330-008 Chapter 8. Lead(II) Complexes of Amino Acids, Peptides, and Other Related Ligands of Biological Interest, s. 201–240.
- ↑ Circular Dichroism, Crystal Structure, and Absolute Configuration of the Siderophore Ferric N,N',N"-Triacetylfusarinine, FeC39H57N6O15. Journal of the American Chemical Society, 1980, s. 5766–5773. DOI: 10.1021/ja00538a012.
- ↑ An evaluation of hydroxamate collectors for malachite flotation. Separation and Purification Technology, August 2017, s. 258–269. DOI: 10.1016/j.seppur.2017.02.056.
- ↑ A review of the beneficiation of rare earth element bearing minerals. Minerals Engineering, February 2013, s. 97–114. DOI: 10.1016/j.mineng.2012.10.017.
Ďalšia literatúra
[upraviť | upraviť zdroj]- FOUCHÉ, K. F.; H. J. le Roux; F. Phillips. Complex formation of Zr(IV) and Hf(IV) with hydroxamic acids in acidic solutions. Journal of Inorganic and Nuclear Chemistry, June 1970, s. 1949–1962. Dostupné online [cit. 2009-04-24]. ISSN 0022-1902. DOI: 10.1016/0022-1902(70)80604-2.
- BAROCAS, A.; F. Baroncelli; G. B. Biondi. The complexing power of hydroxamic acids and its effect on behaviour of organic extractants in the reprocessing of irradiated fuels--II : The complexes between benzohydroxamic acid and thorium, uranium (IV) and plutonium (IV). Journal of Inorganic and Nuclear Chemistry, December 1966, s. 2961–2967. Dostupné online [cit. 2009-04-24]. ISSN 0022-1902. DOI: 10.1016/0022-1902(66)80023-4.
- BARONCELLI, F.; G. Grossi. The complexing power of hydroxamic acids and its effect on the behaviour of organic extractants in the reprocessing of irradiated fuels--I the complexes between benzohydroxamic acid and zirconium, iron (III) and uranium (VI). Journal of Inorganic and Nuclear Chemistry, May 1965, s. 1085–1092. Dostupné online [cit. 2009-04-24]. ISSN 0022-1902. DOI: 10.1016/0022-1902(65)80420-1.
- AL-JARRAH, R. H.; A. R. Al-Karaghouli; S. A. Al-Assaf. Solvent extraction of uranium and some other metal ions with 2-N-butyl-2-ethyl octanohydroxamic acid. Journal of Inorganic and Nuclear Chemistry, 1981, s. 2971–2973. Dostupné online [cit. 2009-04-24]. ISSN 0022-1902. DOI: 10.1016/0022-1902(81)80652-5.
- GOPALAN, Aravamudan S.; Vincent J. Huber; Orhan Zincircioglu. Novel tetrahydroxamate chelators for actinide complexation: synthesis and binding studies. Journal of the Chemical Society, Chemical Communications, 1992, s. 1266–1268. Dostupné online. DOI: 10.1039/C39920001266.
- KOSHTI, Nirmal; Vincent Huber; Paul Smith. Design and synthesis of actinide specific chelators: Synthesis of new cyclam tetrahydroxamate (CYTROX) and cyclam tetraacetonylacetone (CYTAC) chelators. Tetrahedron, 1994-02-28, s. 2657–2664. Dostupné online. ISSN 0040-4020. DOI: 10.1016/S0040-4020(01)86981-7.
Zdroj
[upraviť | upraviť zdroj]Tento článok je čiastočný alebo úplný preklad článku Hydroxamic acid na anglickej Wikipédii.