Acid bromic
| Acid bromic | |
|---|---|
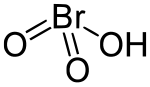 Cấu trúc 2D dạng rỗng của acid bromic | |
 Cấu trúc 3D dạng đặc của acid bromic | |
| Danh pháp IUPAC | Bromic acid |
| Tên khác | Acid bromic(V) Hydro bromat |
| Nhận dạng | |
| Số CAS | |
| PubChem | |
| Số EINECS | |
| MeSH | |
| ChEBI | |
| ChEMBL | |
| Số RTECS | TP8580000 |
| Ảnh Jmol-3D | ảnh ảnh 2 |
| SMILES | đầy đủ
|
| InChI | đầy đủ
|
| ChemSpider | |
| Tham chiếu Gmelin | 25861 |
| Thuộc tính | |
| Công thức phân tử | HBrO3 |
| Khối lượng mol | 128,91014 g/mol |
| Bề ngoài | chất lỏng không màu |
| Điểm nóng chảy | trong dung dịch |
| Điểm sôi | trong dung dịch |
| Độ hòa tan trong nước | trong dung dịch |
| Độ axit (pKa) | -2 |
| Cấu trúc | |
| Các nguy hiểm | |
| Nguy hiểm chính | độc |
| Các hợp chất liên quan | |
| Anion khác | Acid chlorric Acid iodic |
| Hợp chất liên quan | Acid hypobromơ Acid bromơ Acid pebromic |
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |
Acid bromic, tên khác: hydro bromat, là một acid oxo với công thức hóa học HBrO3. Nó chỉ tồn tại ở dạng dung dịch nước.[1][2] Dung dịch không màu này chuyển sang màu vàng ở nhiệt độ phòng do nó phân hủy thành brom.[3] Acid bromic và muối bromat là các chất oxy hóa mạnh và là thành phần phổ biến trong các phản ứng Belousov-Zhabotinsky.[4] Phản ứng Belousov-Zhabotinsky là một ví dụ điển hình về nhiệt động lực học không cân bằng.
Cấu trúc
[sửa | sửa mã nguồn]Có vài dạng đồng phân của HBrO3.[5] Các độ dài kết nối được tính toán được liệt kê dưới đây dựa trên lý thuyết ba mức cấp cao G2MP2, CCSD(T), và QCISD(T).
| Công thức | HOOOBr | HOOBrO | HOBrO2 | HBrO3 |
|---|---|---|---|---|
| Br–O bắc cầu (Å) | 1,867 | 1,919 | 1,844 | ⸺ |
| Br–O cuối (Å) | ⸺ | 1,635 | 1,598 | 1,586 |
Các khoảng cách năng lượng lớn giữa các cấu trúc này không làm cho sự đồng phân có thể xảy ra. HOBrO2 là đồng phân ổn định nhất và được thể hiện trong những hình trên.
Tổng hợp
[sửa | sửa mã nguồn]Acid bromic là sản phẩm của một phản ứng giữa bari bromat và acid sunfuric.
- Ba(BrO3)2 + H2SO4 → 2HBrO3 + BaSO4↓
Bari sunfat không hòa tan trong nước và tạo thành kết tủa. Acid bromic trong nước có được khi loại bỏ kết tủa bari sunfat.
Tính chất
[sửa | sửa mã nguồn]Acid bromic không tồn tại trong trạng thái tự do, trong dung dịch nước nó là một chất lỏng không màu (hoặc hơi màu vàng) với nồng độ tối đa lên đến 50%.[cần dẫn nguồn]
Nó là một acid mạnh với pKa = -2.
Tham khảo
[sửa | sửa mã nguồn]- ^ The Merck Index: An Encychlorpedia of Chemicals, Drugs, and Biologicals. 14th Edition. 2006.
- ^ Van Nostrand's Scientific Encychlorpedia. Glenn D. Considine. Ninth Edition. Volume 1. p 554
- ^ Recipes for Belousov-Zhabotinsky reagents. J. Chem. Educ., 1991, 68 (4), 320. DOI: 10.1021/ed068p320
- ^ The Source of the Carbon Monoxide in the Classical Belousov-Zhabotinsky Reaction. J. Phys. Chem. A., 2007, 111 (32), 7805–12 DOI: 10.1021/jp073512+
- ^ A Theoretical Examination of the Isomerization Pathways for HBrO3 Isomers. J. Phys. Chem. A, 2000, 104 (41), 9321-27. DOI: 10.1021/jp001604s
