咪唑
| 咪唑 | |
|---|---|

| |

| |
| IUPAC名 1,3-diazole 1,3-二唑 | |
| 英文名 | Imidazole |
| 别名 | 间二氮茂、咁𫫇啉 |
| 识别 | |
| CAS号 | 288-32-4 |
| PubChem | 795 |
| ChemSpider | 773 |
| SMILES |
|
| InChI |
|
| InChIKey | RAXXELZNTBOGNW-UHFFFAOYAS |
| EINECS | 206-019-2 |
| ChEBI | 16069 |
| RTECS | N13325 1985-86 |
| KEGG | C01589 |
| 性质 | |
| 化学式 | C3H4N2 |
| 摩尔质量 | 68.08 g·mol⁻¹ |
| 外观 | 白色或浅黄色固体 |
| 密度 | 1.23 g/cm3 |
| 熔点 | 89-91 ℃ (362-364 K) |
| 沸点 | 256 ℃ (529 K) |
| 溶解性(水) | 易溶 |
| pKa | 14.5 |
| pKb | 6.95 |
| 结构 | |
| 晶体结构 | 单斜 |
| 分子构型 | 平面五元环 |
| 危险性 | |
| NFPA 704 | |
| 闪点 | 146 ℃ |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
咪唑[注 1](英语:Imidazole),即1,3-二氮唑,是一个五元杂环芳香性有机化合物,化学式C
3H
4N
2。它也是一个生物碱。白色或浅黄色固体结晶,可溶于水、氯仿、醇、醚,具有碱性。氢原子在两个氮原子之间移动,因此存在两个互变异构体。
咪唑环结构在生物分子中广泛存在,例如组氨酸和对应的荷尔蒙组胺。很多药物也包含有咪唑环,例如硝基咪唑和咪唑类抗真菌药物。[1][2][3][4][5]
发现
[编辑]早在1840年代,多种咪唑的衍生物就已经被发现。1858年,Heinrich Debus首次合成了咪唑。他合成咪唑的方法是用乙二醛和甲醛在氨中进行反应,所以此法又称狄博斯法。[6] 这一合成方法虽然效率很低,但目前仍用于合成C取代的咪唑,也是目前工业上合成咪唑的常用方法之一。

在一个微波改性反应中1,2-二苯基乙二酮、苯甲醛和氨在冰醋酸中生成2,4,5-三苯基咪唑(又称洛粉碱)。[7]
结构与性质
[编辑]咪唑为平面五元环状化合物,易溶于水(以无限比例)和其它极性溶剂。咪唑的两个氮原子间存在永久偶极,极性很强,偶极矩为3.61D,并且分子间存在氢键缔合,导致了咪唑具有反常高的沸点(256℃)。分子中存在一个6电子共轭大π键,故具有典型的芳香性。与氢以σ键相连的氮原子提供一对电子,环内其余四个原子各提供一个电子成键。
1N上有氢的咪唑环中,氢原子可以在两个氮原子间迁移,存在两个互变异构体,C-4和C-5是等同的。这两个互变异构体无法分离,当有取代基时,常以“4(5)-取代咪唑”(如4(5)-甲基咪唑)来命名。
两性化合物
[编辑]咪唑具有两性,即同时表现出酸性与碱性。作为一种酸,咪唑的pKa是14.5,它的酸性比羧酸、酚类与酰亚胺弱,但稍微比醇强。可离解质子在N-1上。作为碱,咪唑的共轭酸的pKa(上文提到的为pKBH+以避免混淆)大约是7,使咪唑碱性比吡啶强约六十倍以上,可以和无机酸生成稳定且易溶于水的盐。体现碱性的原子为N-3。
咪唑的一些共振结构如下所示:

反应
[编辑]咪唑比其他1,3-二唑更容易发生亲电芳香取代反应,并且反应主要在C-4和C-5上进行。这是因为亲电试剂进攻C-2时,有特别不稳定的极限式,生成的中间体将正电荷分布在氮原子上。例如,咪唑与发烟硝酸/浓硫酸作用,可以很快生成产率很高的4(5)-硝基咪唑;而4,5-二甲基咪唑在剧烈条件下硝化,仍然不能发生反应。
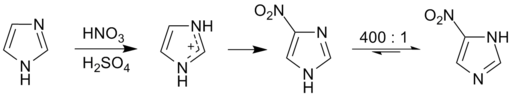
咪唑N-3上的电子云密度较大,所以烷基化反应一般都先在这个氮原子上发生。一烷基化的产物通过互变异构,又可以产生一个类似于吡啶中的氮原子,因此可以进一步反应,生成二烷基化的产物咪唑𬭩盐。
咪唑的酰基化反应一般也在N-3上发生,但由于酰基是吸电子基,故反应能控制在一元酰基化阶段,产物是N-酰基咪唑。
咪唑的活泼氢可以分解格氏试剂,生成咪唑的N-镁盐,经异构化后得到C-2取代的咪唑。后者用碘甲烷处理,可以生成1,2-二甲基咪唑。
咪唑可与亲双烯体发生加成,先生成3-𬭩盐两性离子,然后与另一分子亲双烯体亲核加成,生成C-2环化的产物。例如1-甲基-2-乙基咪唑与两分子丁炔二酸二甲酯反应后,得到8a-乙基-1-甲基-1,8a-二氢咪唑并[1,2-a]吡啶-5,6,7,8-四羧酸四甲酯。
咪唑盐
[编辑]
咪唑环上的氮原子被质子化或取代时可以形成咪唑𬭩盐(如氯化咪唑)。这些盐是咪唑离子液体和很多稳定卡宾的前体。
咪唑也可形成阴离子与金属成盐,如咪唑钠、咪唑钾,以及不溶性的咪唑银盐。咪唑钾可由咪唑与氢氧化钾反应得到,它与卤代烃反应,生成N-烷基咪唑,后者在加热时可以异构化生成2-烷基咪唑。
制备
[编辑]除了狄博斯法外,咪唑还可用多种方法合成。如果在反应中引入其它官能团,这些方法也可以应用于咪唑衍生物的合成。在文献中,这些方法通常按照合成咪唑环时新形成的化学键数分类。例如,狄博斯方法在合成咪唑环时形成了(1,2)、(3,4)和(1,5)三个键,所以这种方法是一个三键合成。以下列出几个有代表性的合成路线:
- 单键合成反应
咪唑环的(1,5)或(3,4)键可在α-氨基二乙缩醛与亚氨酸酯作用生成脒再进一步生成咪唑的反应中生成。

- 双键合成反应
高温加热1,2-脂肪二胺与乙醇、乙醛或羧酸混合物可生成咪唑环的(1,2)和(2,3)键。此反应需要脱氢催化剂如铂或氧化铝的催化。

工业上用邻苯二胺与甲酸反应生成苯并咪唑,用双氧水处理,开环转化为咪唑-4,5-二羧酸,最后与氧化铜混合加热,发生脱羧生成咪唑。或者也可用酒石酸与发烟硝酸和浓硫酸混合搅拌后,得到酒石酸二硝酸酯,然后与氨水、甲醛反应,生成的二羰基丁二酸未经分离便转化为咪唑-4,5-二羧酸,最后脱羧生成咪唑。
加热N-取代α-氨基酮与甲酰胺可形成咪唑环的(1,2)和(3,4)键。产物是一个1,4-取代咪唑,如果R1 = R = H,则产物是咪唑。

此外,咪唑还可由链中含有氮原子的1,4-二羰基化合物,在与铵盐加热时环化得到。原料二酮可通过α-卤代酮发生氨解得到α-氨基酮,然后再与酸酐或酰氯反应制得。
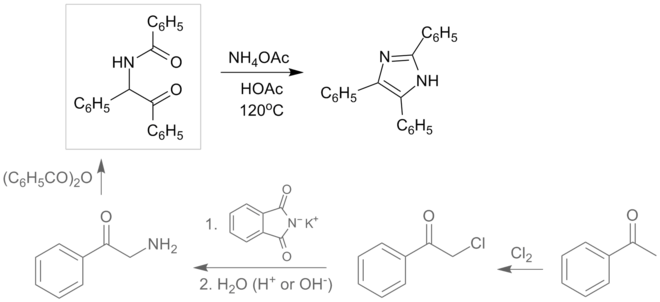
- 四键合成反应
这是一个常见的生成取代咪唑的方法,由狄博斯法改良而来,产率一般较高。原料为取代乙二醛、醛、胺和氨或铵盐。[8]

- 由其他杂环化合物生成
咪唑可由1-乙烯基四唑的光解反应合成。如果1-乙烯基四唑可以大量地由有机锡化合物(如2-三丁基锡基四氮唑)制得,反应收率较高。

咪唑也可以由气相反应制得。甲酰胺、乙二胺和氢气在载铂氧化铝催化下加热至340到480℃可生成纯度非常高的咪唑。
生物学意义和应用
[编辑]在许多重要的生物分子中含有咪唑官能团。最常见的是含有咪唑侧链的组氨酸。组氨酸出现在许多蛋白质和酶中,也是血红蛋白的重要结构组成,对其配位能力具有重要意义。蛋白质中的His残基可以扮演酸碱两性基团,因此常是酶中发生酸碱催化机理的部分(如碳酸酐酶)。组氨酸可发生脱羧生成组胺,这也是一种常见的生物分子,具有降低血压,收缩子宫等功能。细胞释放的组胺常是导致荨麻疹的原因之一。组氨酸生成组胺的反应如下所示:
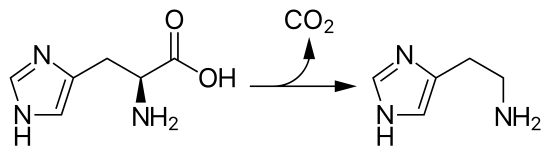
咪唑一个用途是在金属螯合亲和层析(IMAC)中用于His标签蛋白的纯化。标签蛋白与层析柱表面珠孔内的镍离子介质发生结合,过量的咪唑通过层析柱,将与镍配位的标签蛋白洗脱下来,得到高纯度的目标蛋白。
咪唑是许多药品的重要组成部分。许多杀菌剂和抗真菌、抗原虫和抗高血压的药物中含有合成咪唑。咪唑是茶叶和咖啡豆中含有的茶碱分子的组成部分,具有刺激中枢神经系统的作用。通过干扰DNA的活动抑制白血病的抗癌药物巯嘌呤中也含有咪唑。
工业应用
[编辑]许多工业上的重要化合物含有咪唑衍生物。耐高温的聚苯并咪唑材料(PBI)含有苯并咪唑(咪唑与苯环稠合)和另一个苯环相连的结构,PBI可用作阻燃剂。咪唑的各种化合物也常见于摄影和电子产品中。
参见
[编辑]注释
[编辑]参考文献
[编辑]- ^ Katritzky; Rees. Comprehensive Heterocyclic Chemistry. Vol. 5, p.469-498, (1984).
- ^ Grimmett, M. Ross. Imidazole and Benzimidazole Synthesis. Academic Press, (1997).
- ^ Brown, E. G. Ring Nitrogen and Key Biomolecules. Kluwer Academic Press, (1998).
- ^ Pozharskii, A. F., et al. Heterocycles in Life and Society. John Wiley & Sons, (1997).
- ^ T. L. Gilchrist. Heterocyclic Chemistry. The Bath press. 1985. ISBN 978-0-582-01421-3
- ^ Heinrich Debus (1858). "Ueber die Einwirkung des Ammoniaks auf Glyoxal". Annalen der Chemie und Pharmacie 107 (2): 199 – 208. doi:10.1002/jlac.18581070209.
- ^ Crouch, R. David; Howard, Jessica L.; Zile, Jennifer L.; Barker, Kathryn H. Microwave-Mediated Synthesis of Lophine: Developing a Mechanism To Explain a Product. J. Chem. Educ. 2006, 83 (1658).
- ^ US6,177,575 (页面存档备份,存于互联网档案馆) (PDF version (页面存档备份,存于互联网档案馆)) (2001-01-23) Anthony J. Arduengo, III, Process for Manufacture of Imidazoles.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|

