Cianogena klorido
| Cianogena klorido | |||||
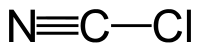 | |||||
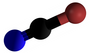
| Plata kemia strukturo de la Cianogena klorido | |||||
 | |||||
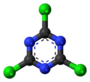
| Tridimensia kemia strukturo de la Cianogena klorido | |||||
| Alternativa(j) nomo(j) | |||||
| |||||
| Kemia formulo | |||||
| CAS-numero-kodo | 506-77-4 | ||||
| ChemSpider kodo | 10045 | ||||
| PubChem-kodo | 10477 | ||||
| Merck Index | 15,2684 | ||||
| Fizikaj proprecoj | |||||
| Aspekto | senkolora, toksa, koroda, larmiga, rapidbola gaso kun tranĉa odoro | ||||
| Molmaso | 61,468 g·mol−1 | ||||
| Denseco | 1,186g cm−3[1] | ||||
| Fandpunkto | −6 °C | ||||
| Bolpunkto | 13,8 °C | ||||
| Ekflama temperaturo | Nebrulema | ||||
| Solvebleco | Akvo:Tute solvebla | ||||
| Mortiga dozo (LD50) | 170 ppm | ||||
| Sekurecaj Indikoj | |||||
| Riskoj | R26 R35 | ||||
| Sekureco | S1 S9 S26 S36/37/39 S45 | ||||
| Pridanĝeraj indikoj | |||||
| Danĝero
| |||||
| GHS Damaĝo Piktogramo |
| ||||
| GHS Signalvorto | Damaĝa substanco | ||||
| GHS Deklaroj pri damaĝoj | H280, H300, H310, H314, H318, H330, H400 | ||||
| GHS Deklaroj pri antaŭgardoj | P260, P262, P264, P270, P271, P273, P280, P284, P301+310, P301+330+331, P303+361+353, P304+340, P305+351+338, P310, P320, P321, P330, P361, P363, P391, P403+233, P405, P410+403, P501[2] | ||||
(25 °C kaj 100 kPa) | |||||
Cianogena klorido aŭ C≡N-Cl estas organika kombinaĵo de kloro kaj cianido, senkolora, toksa, koroda, larmiga, rapidbola gaso kun tranĉa odoro, uzata kiel larmiga gaso dum la grandaj mondmilitoj. La substanco estas alte venena kaj kaŭzas iriton al okuloj, haŭto kaj spirsistemo.
Oni atribuas ĝian toksecon al formado de cianida acido en la interno de la ĉeloj. Ĝiaj vaporoj estas pli densaj ol aero. Longedaŭra ekspozicio de la ujo ĝin enhavanta al fajro aŭ intensa varmo povas kaŭzi eksplodon aŭ rompon. Cianogena klorido povas eksplode trimerizi aŭ kvarmerizi por formi triazinojn. Ĝi troege reakcias kun alkenoj kaj alkinoj.
Klorido de cianogeno ankaŭ estas uzata kiel fumigaĵo, metalpurigaĵo, en erco-rafinado, produktado de sinteza kaŭĉuko kaj en diversaj kemiaj sintezoj. Cianogena klorido estis unue raportita de la franca kemiisto Claude Louis Berthollet (1748-1822) en jaro 1789.
Sintezoj
[redakti | redakti fonton]Sintezo 1
[redakti | redakti fonton]- Preparado per traktado de kalia kvarcianozinkato kaj kloro:
Sintezo 2
[redakti | redakti fonton]- Preparado per interagado de natria cianido kaj kloro:
Sintezo 3
[redakti | redakti fonton]Sintezo 4
[redakti | redakti fonton]- Preparado ekde la cianogena bromido:
Sintezo 5
[redakti | redakti fonton]- Preparado ekde la cianogena jodido:
Sintezo 6
[redakti | redakti fonton]- Preparado per agado de la trimetilsilicil-klorido kun kloro:
Reakcioj
[redakti | redakti fonton]Reakcio 1
[redakti | redakti fonton]- Trimerizo de la cianogena klorido:
Reakcio 2
[redakti | redakti fonton]- Kvarmerizo de la cianogena klorido:
Reakcio 3
[redakti | redakti fonton]- Reakcio kun sulfura trioksido:
Reakcio 4
[redakti | redakti fonton]- Reakcio kun natria hidroksido:
Reakcio 5
[redakti | redakti fonton]- Hidrolizo de la cianogena klorido:
Reakcio 6
[redakti | redakti fonton]- Hidrolizo de la cianogena klorido per 2 molumoj da akvo:
Reakcio 7
[redakti | redakti fonton]- Reakcio kun amoniako:
Reakcio 8
[redakti | redakti fonton]- Reakcio kun metilmagnezia klorido:
Reakcio 9
[redakti | redakti fonton]- Reakcio kun benzeno:
Reakcio 10
[redakti | redakti fonton]- Reakcio kun natrio:
Literaturo
[redakti | redakti fonton]- Toxnet
- Encyclopedia Britannica
- Fire Engineering Arkivigite je 2019-01-17 per la retarkivo Wayback Machine
- Chemical Book
- Chemical Warfare Agents
- A Comprehensive Guide to the Hazardous Properties of Chemical Substances







![{\displaystyle {\mathsf {{\xrightarrow[{\,}]{}}\,}}}](http://178.128.105.246/content-https-wikimedia.org/api/rest_v1/media/math/render/svg/3a133815724e6bf6cfb39eb43f1e6c1d96ea8d17)