Usuario:Acratta/Pruebas
Químicos de los siglos XVII, XVIII y XIX
-
Guillaume-François Rouelle
-
van Helmont
-
Black
-
Priestley
-
Lavoisier
-
Proust
-
Richter
-
Berthollet
-
Dalton
-
Gay-Lussac
-
Avogadro
-
Liebig
-
Faraday
- Berzelius tomando los resultados y las publicaciones de Proust, Rhichter, Dalton y Gay-Lussac, en 1914 publica un trabajo en el que propone los simbolos químicos y realiza la siguiente pregunta:
What is the specific gravity of all other elementary bodies in the form of gas, compared with that of the oxygen?
Entonces toma al oxígeno como la unidad = 100% y las compara a las gravedades específicas de los otros elementos en estado gaseoso y encuentra por elemplo que el oxígeno es al hidrógeno 100:6,6 y el un cociente de 15,2 esto es que si el hidrogeno es uno el oxígeno es 16 y como el agua tiene 2 hidrógenos por uno de oxigeno entonces el quivalente del oxígeno es 8 (???).
Proporciones reciprocas de Richter publicadas por Fisher en 1802
| Weights of Acids and Bases that are Chemically Equivalent | |||
| Bases | Acids | ||
| Name | Parts required to titrate | Name | Parts required to titrate |
| Alumina (aluminium oxide) | 525 | Carbonic acid | 577 |
| Magnesia | 615 | Muriatic acid (hydrochloric acid) | 712 |
| Lime (calcium carbonate) | 793 | Phosphoric acid | 979 |
| Calcium hydroxide | 793 | Oxalic acid | 755 |
| Soda (sodium carbonate) | 859 | Sulphuric acid | 1000 |
| Potash (potassium carbonate) | 1605 | Aqua fortis (nitric acid) | 1405 |
| Barite (barium sulfate) | 2222 | Acetic acid | 1480 |
Modelos y Fórmulas desarrolladas:
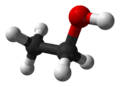
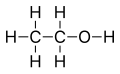
Tres representaciones del Etanol
-
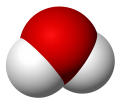
Molécula de agua, "disolvente universal", de importancia fundamental en innumerables procesos bioquímicos e industriales
-
Representación poliédrica del anión de Keggin, un polianión molecular
-
Modelo de cintas de una proteína
-
Ácido aspártico
Fórmula molecular
[editar]Óxidos básicos
| Fórmula molecular | Nombre | PM (g/mol) |
| Na2O | óxido de sodio | 62 |
| K2O | óxido de potasio | 94,2 |
| CaO | óxido de calcio | |
| MgO | óxido de magnesio |
Hidróxidos
| Fórmula molecular | Nombre | |
| NaOH | hidróxido de sodio | |
| KOH | hidróxido de potasio | |
| Ca(OH)2 | hidróxido de calcio | |
| Mg(OH)2 | hidróxido de magnesio |
Óxidos ácidos
| Fórmula molecular | Nombre |
| N2O | óxido nitroso |
| NO2 | dióxido de nitrógeno |
| SO2 | dióxido de azufre |
| SO3 | trióxido de azufre |
Ácidos
| Fórmula molecular | Nombre |
| HCl | ácido clorhídrico |
| H3PO4 | ácido fosfórico |
| H2SO3 | ácido sulfuroso |
| H2SO4 | ácido sulfúrico |
Minerales
| Nombre | Fórmula mínima |
| Antofilita | (Mg,Fe)7Si8O22(OH)2 |
| Tremolita | Ca2Mg5Si8O22(OH)2 |
| Actinolita | Ca2(Mg,Fe)5Si8O22(OH)2 |
| Cummingtonita | Fe2Mg5Si8O22(OH)2 |
| Grunerita | Fe7Si8O22(OH)2 |
| Hornblenda | Ca2(Mg,Fe,Al)5(Al,Si)8O22(OH)2 |
| Glaucofana | Na2(Mg,Fe)3Al2Si8O22(OH)2 |
| Arfvedsonita | Na3Fe2+4Fe3+Si8O22(OH)2 |
| Crocidolita | Na2Fe2+3Fe3+2Si8O22(OH)2 |
| Nombre común | Símbolo | Nombre tradicional | Ejemplo | Fórmula molecular |
|---|---|---|---|---|
| Cationes simples | ||||
| Aluminio | Al3+ | Aluminio | cloruro de aluminio | AlCl3 |
| Bario | Ba2+ | Bario | sulfato de bario | BaSO4 |
| Calcio | Ca2+ | Calcio | Carbonato de calcio | CaCO3 |
| Cromo (II) | Cr2+ | Cromoso | ||
| Cromo (III) | Cr3+ | Crómico | ||
| Cromo (VI) | Cr6+ | Percrómico | ||
| Cobalto (II) | Co2+ | Cobaltoso | ||
| Cobalto (III) | Co3+ | Cobáltico | ||
| Cobre (I) | Cu+ | Cuproso | ||
| Cobre (II) | Cu2+ | Cúprico | ||
| Hierro (II) | Fe2+ | Ferroso | Óxido ferroso | FeO |
| Hierro (III) | Fe3+ | Férrico | Óxido férrico | Fe2O3 |
| Plomo (II) | Pb2+ | Plumboso | ||
| Plomo (IV) | Pb4+ | Plúmbico | ||
| Litio | Li+ | Litio | ||
| Magnesio | Mg2+ | Magnesio | ||
| Manganeso (II) | Mn2+ | Hipomanganoso | ||
| Manganeso (III) | Mn3+ | Manganoso | ||
| Manganeso (IV) | Mn4+ | Mangánico | ||
| Manganeso (VII) | Mn7+ | Permangánico | ||
| Mercurio (II) | Hg2+ | Mercúrico | ||
| Níquel (II) | Ni2+ | Niqueloso | ||
| Níquel (III) | Ni3+ | Niquélico | ||
| Potasio | K+ | Potasio | ||
| Plata | Ag+ | Argéntico | ||
| Sodio | Na+ | Sodio | ||
| Estroncio | Sr2+ | Estroncio | ||
| Estaño (II) | Sn2+ | Estanoso | ||
| Estaño (IV) | Sn4+ | Estánico | ||
| Zinc | Zn2+ | Zinc | ||
| Cationes poliatómicos | ||||
| Amonio | NH4+ | |||
| Hidronio | H3O+ | |||
| Nitronio | NO2+ | |||
| Mercurio (I) | Hg22+ | Mercurioso | ||
Diagramas bidimensionales
[editar]-
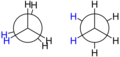
Proyección de Newman del etano
-
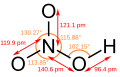
Diagrama con angulos y distancia de elace del ácido nítrico
-
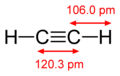
Diagrama con angulos y distancia de elace del acetileno
Diagramas tridimensionales
[editar]-
Efedrina
-
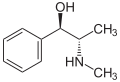
Adrenalina
-
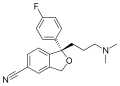
Fórmula esqueletal del fármaco antidepresivo escitalopram, mostrando los heteroátomos, un enlace triple, anillos de benceno y la estereoquímica
-
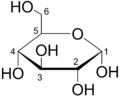
proyección de Haworth de la α-D-glucosa, es una forma común de representar la fórmula estructural cíclica de los monosacáridos con una perspectiva tridimensional simple.
Reacciones
[editar]Ecuación de la :
H2SO4 + Na2CrO4 → CrO3 + Na2SO4 + H2O
reacción del ácido sulfúrico con el cromato de sodio
síntesis de cloruro de tionilo
Ca(OH)2 (aq) + Na2CO3 (aq) → 2 NaOH (aq) + CaCO3 (s)
reacción de doble desplazamiento
Leyes de Gay Lussac
[editar]En 1802 Gay Lussac publica dos leyes sobre las propiedades de los gases que relacionan su volumen con la temperatura y la presión. La primera de ellas ya había sido propuesta por Charles por lo que es conoce con el nombre de Ley de Charles Gay Lussac o primera Ley de Gay Lussac; La segunda relaciona el volumen de un gas cuando es sometido a diferentes presiones y se conoce con el nombre de segunda Ley de Gay Lussac.
Por otro lado Gay Lussac publica en 1808 una ley estequiométrica que relaciona los volúmenes de los reactivos con el volumen de los productos en una reacción química en fase gaseosa o de vapor, llamada Ley de los volúmenes de combinación, que es la que utiliza Avogadro para proponer su hipótesis.
Un móvil que se desplaza con una aceleración de 0,66 m/s2 recorre una distancia d que está en función del tiempo transcurrido t. Se dice que d es la variable dependiente de t, la variable independiente. Estas magnitudes, calculadas a priori o medidas en un experimento, pueden consignarse de varias maneras. (Se supone que el cuerpo parte en un instante en el que se conviene que el tiempo es t = 0 s.)
Los valores de las variables pueden recogerse en una tabla, anotando la distancia recorrida d en un cierto instante t, para varios momentos distinos:
| Tiempo t (s) | Distancia d (m) | Velocidad instantanea v(m/s) |
|---|---|---|
| 0,0 | 0,0 | 0 |
| 0,5 | 0,1 | 0,2 |
| 1,0 | 0,3 | 0,3 |
| 1,5 | 0,7 | 0,47 |
| 2,0 | 1,3 | 0,65 |
| 2,5 | 2,0 | 0,8 |