Acide organique
Un acide organique est un composé organique présentant des propriétés acides, c'est-à-dire capable de libérer un cation (ion chargé positivement) H+, ou H3O+ en milieux aqueux.
Caractéristiques générales
[modifier | modifier le code]Les acides organiques sont en général plus faibles que les acides minéraux : il ne se dissocient pas totalement dans l'eau, contrairement à ces derniers. Les acides organiques à masse moléculaire faible, tels que l'acide formique ou l'acide lactique sont miscibles dans l'eau, mais ceux avec une masse moléculaire élevée (composés aromatiques, composés à longue chaine carbonée), comme l'acide benzoïque ne sont que très peu solubles dans l'eau. Au contraire, la plupart des acides organiques sont très solubles dans les solvants organiques, avec néanmoins quelques exceptions, dans le cas de la présence de substituants affectant la polarité du composé. L'acide paratoluènesulfonique (APTS) est un acide relativement fort très souvent utilisé en chimie organique car capable de se dissoudre dans les solvants organiques.
Groupes d'acides organiques
[modifier | modifier le code]Les acides organiques les plus courants sont les acides carboxyliques, dont l'acidité est due à un groupe carboxyle –COOH, et qui sont en général des acides faibles. On compte également dans cette catégorie les acides sulfoniques, porteur d'un groupe –SO2OH, qui sont eux des acides relativement forts. D'autres groupes organiques peuvent conférer des propriétés acides, en général faibles : hydroxyle (–OH), sulfhydryle (–SH), énol ou groupe phénol. Ces derniers, en général des acides très faibles, sont d'autant plus forts que leur base conjuguée est stable. Ainsi le phénol et l'acétoacétate d'éthyle possèdent des propriétés acides grâce à la stabilisation de leur base conjuguée, et l'acide ascorbique, qui ne comporte aucun groupe acide organique habituel, mais réagit par une fonction énol, et dont la base conjuguée énolate est stabilisée par mésomérie, est plus fort que de nombreux acides carboxyliques.
Acides carboxyliques
[modifier | modifier le code]
Les acides carboxyliques, bien que généralement des acides faibles, sont tout de même en général beaucoup plus acides que la plupart des autres acides organiques, comme les alcools. Leur acidité croit en fonction de la présence de groupes électro-attracteurs dans le voisinage du groupe carboxyle (positions α, β ou γ) qui stabilisent leur base conjuguée. L'acide trifluoroacétique ou l'acide trichloroacétique sont des acides bien plus fort que l'acide lactique, qui est lui-même plus fort que l'acide acétique. Les acides carboxyliques avec une chaîne carbonée de un à trois atomes de carbone ont une odeur piquante, sont corrosifs pour la peau humaine et très solubles dans l'eau. Les acides carboxyliques avec une chaîne carbonée de quatre à neuf atomes de carbone ont une forte odeur rance, l'exemple le plus connu étant l'acide butyrique, responsable de l'odeur de beurre rance. Les acides carboxyliques avec plus de dix atomes de carbone sont des solides cireux (acides gras), inodores et quasiment insolubles dans l'eau.
Acides benzoïques
[modifier | modifier le code]Les acides benzoïques sont une sous-classe d'acides carboxyliques, dans laquelle le groupe carboxyle est lié à un noyau benzénique qui facilite la stabilisation de la base conjuguée et les rend donc en général plus acides que les acides carboxyliques non aromatiques. Le plus simple composé de cette classe est l'acide benzoïque. La plupart des acides benzoïques sont peu solubles, voire insolubles dans l'eau.
Alcools, énols, phénols
[modifier | modifier le code]
Les alcools non substitués ont une acidité très faible. Les phénols et les naphtols, ont par contre, de par leur structure aromatique, une forte stabilisation par résonance de leur base conjuguée (phénolate ou naphtolate) et sont donc facilement déprotonés ; le phénol a ainsi un pKA de 9,9, ce qui fait de lui un acide faible, mais est bien plus acide que les alcanols, tels que l'éthanol (pKA de 16). Les substituants avec un effet -I ou -M augmente la stabilisation de la charge négative de la base conjuguée et augmentent la force de l'acide[1]. Ceci peut résulter en des acides organiques relativement forts, comme l'acide picrique (pKA de 0,38, base conjuguée stabilisée par trois groupes nitro, ayant un effet -M) ou encore le pentachlorophénol (effet -I du chlore). Pour certains substituants, comme les atomes d'halogènes ou les groupes nitro, les deux effets peuvent se conjuguer — mais parfois dans de sens opposés. L'acide ascorbique, un ènediol, a un pKA de 4,2, ce qui le rend plus acide que l'acide acétique (pKA de 4,8).
Thiols
[modifier | modifier le code]Les thiols sont les équivalents soufrés des alcools. Ils sont en général plus acides que leurs équivalents alcools, l'ion thiolate étant plus stable que l'alcoolate. C'est par exemple le cas pour l'éthanethiol (pKA de 12), bien plus acide que l'éthanol (pKA de 16).
Esters d'acide sulfurique et acides sulfoniques
[modifier | modifier le code]
Les monoesters de l'acide sulfurique et les acides sulfoniques ont des acidités comparables à celle de l'acide sulfurique. Cela est dû à l'effet +I qui se propage le long de la chaîne alkyle et stabilise l'anion résultant. L'acide paratoluènesulfonique (APTS) a un pKA d'environ 0,7, l'ester du dodécanol (alcool laurylique) et de l'acide sulfurique, le « sulfate de lauryle » un pKA de -0,09.
Composés acides CH et NH
[modifier | modifier le code]Exemples
[modifier | modifier le code]| Classe | Groupe fonctionnel acide | Représentation | pKA à 25 °C |
|---|---|---|---|
| Acide carboxylique | Carboxyle : R–COOH | 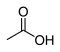 Acide acétique Acide acétique |
4,8 |
| Acide carboxylique substitué |
Carboxyle : R–CHxXy–COOH |  Acide trifluoroacétique Acide trifluoroacétique |
0,23[2] |
| Acide benzoïque | Carboxyle : Ar–COOH | 4,2[2] | |
| Alcool | Hydroxyle : R–OH | 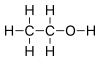 Éthanol Éthanol |
16 |
| Phénol | Hydroxyle : Ar–OH (Ar=Aryle) |
 Phénol Phénol |
9,9[3] |
| Naphtol | Hydroxyle : Ar–OH (Ar=Aryle) |
 α-naphtol α-naphtol |
3,7[3] |
| Phenol substitué (Substituant avec effet -I comme un halogène, nitro) |
Hydroxyle : O2N–Ar–OH (Ar=Aryle) |
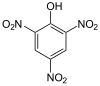 Acide picrique Acide picrique |
0,4[3] |
| Énol | Hydroxyle (énol) : C=C–OH |  Acide ascorbique Acide ascorbique |
4,2 |
| Thiol | R–SH | 12[4] | |
| Ester sulfurique (Sulfate) |
R–O–SO3H | Sulfate de lauryle | −0,09 [5] |
| Acide sulfonique | R–SO3H | H3C–SO3H acide méthylsulfonique | −1,9[6] |
| Acide sulfonique | R–Ar–SO3H (Ar=Aryle) |
H3C–C6H4–SO3H acide paratoluènesulfonique | ~ 0,7[7] |
| Phosphate | R–O–PO(OH)2 | Adénosine monophosphate | 3,3[2] |
| Phosphononate | R–PO(OH)2 | H3C–PO(OH)2 acide méthylphosphonique | 2,35 |
| Composé acide C-H Alcyne |
H–CC–R | 25 | |
| Composé acide C-H Nitroalcane |
O2N–CRR'–H | 8,6[8] | |
| Composé acide C-H β-dicarbonyle |
RC=OCH2C=OR' | ≈ 9[9] | |
| Composé acide N-H Imide |
R–(CO)2N–H |  Phtalimide Phtalimide |
8,3[10] |
| Acide inorganique, pour comparaison | |||
| Acide minéral | HO–SO2–OH | −3 | |
Notes et références
[modifier | modifier le code]- (de) Alfons Hädener et Heinz Kaufmann, Grundlagen der organischen Chemie, Springer, 2006 (ISBN 978-3-7643-7040-4)
- (en) pKa Data Compiled by R. Williams
- (de) C. Lüders, Entwicklung von Analysenverfahren und Referenzmaterialien für die Bestimmung von Phenolen in umweltrelevanten Matrices, Dissertation an der Humboldt-Universität zu Berlin, 12 octobre 1999
- (de) ChemieOnline Buchstabe E (Ethylmercaptan)
- (en) P.H. Stahl et C.G. Wermuth, Handbook of Pharmaceutical Salts: Properties, Selection, and Use, 2002, Helvetica Chimica Acta (ISBN 3-906390-26-8)
- (en) Kurt Kosswig, Sulfonic Acids, Aliphatic, Wiley-VCH Verlag, coll. « Ullmann's Encyclopedia of Industrial Chemistry » (DOI 10.1002/14356007.a25_503)
- (de) ChemieOnline Buchstabe P
- (de) ChemieOnline Buchstabe N
- (de) ChemieOnline Buchstabe A
- (de) Hans Beyer et Wolfgang Walter, Organische Chemie, S. Hirzel Verlag, Stuttgart, 1984, p. 521 (ISBN 3777604062)
- (en)/(de) Cet article est partiellement ou en totalité issu des articles intitulés en anglais « Organic acid » (voir la liste des auteurs) et en allemand « Organische Säuren » (voir la liste des auteurs).

