Rasagiline
| Rasagiline | ||
| ||
 | ||
| Identification | ||
|---|---|---|
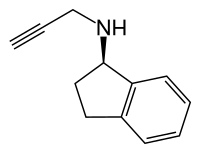
| Nom UICPA | (1R)-N-(prop-2-yn-1-yl)-2,3-dihydro-1H-indé-1-amine | |
| No CAS | ||
| No ECHA | 100.301.709 | |
| Code ATC | N04 | |
| DrugBank | DB01367 | |
| SMILES | ||
| InChI | ||
| Propriétés chimiques | ||
| Formule | C12H13N [Isomères] |
|
| Masse molaire[1] | 171,238 3 ± 0,010 7 g/mol C 84,17 %, H 7,65 %, N 8,18 %, |
|
| Unités du SI et CNTP, sauf indication contraire. | ||
| modifier |
||
La rasagiline est un inhibiteur irréversible de la monoamine oxydase, utilisé en monothérapie en début de maladie de Parkinson ou comme une thérapie adjuvante dans les cas plus avancés.
Synthèse
[modifier | modifier le code]La rasagiline a été développée dans les années 1990 par Teva Neuroscience, les laboratoires Lundbeck en ayant acquis la licence pour l'Europe[2].
Pharmacologie
[modifier | modifier le code]La rasagiline est un inhibiteur de la mono-amine oxydase-B qui, contrairement à la sélégiline, ne serait pas transformée en métabolites toxiques[3].
Mécanisme d'action
[modifier | modifier le code]La maladie de Parkinson est caractérisée par la mort des neurones qui produisent la dopamine, un neurotransmetteur. Une enzyme appelée monoamine oxydase (MAO) décompose les neurotransmetteurs. La MAO se présente sous deux formes, la MAO-A et la MAO-B. La MAO-B décompose la dopamine. La rasagiline empêche la dégradation de la dopamine en se liant de manière irréversible à la MAO-B. La dopamine est donc plus disponible, ce qui compense quelque peu la diminution des quantités produites dans le cerveau des personnes atteintes de la maladie de Parkinson[4].
La sélégiline a été le premier inhibiteur sélectif de la MAO-B. Elle est partiellement métabolisée in vivo en lévométhamphétamine (l-méthamphétamine), l'un des deux énantiomères de la méthamphétamine[5],[6]. Si ces métabolites peuvent contribuer à la capacité de la sélégiline à inhiber le recaptage des neurotransmetteurs dopamine et norépinéphrine, ils ont également été associés à une hypotension orthostatique et à des hallucinations chez certaines personnes[6],[7],[8] . La rasagiline se métabolise en 1(R)-aminoindane qui n'a pas de caractéristiques semblables à celles des amphétamines[9] et qui présente des propriétés neuroprotectrices dans les cellules et dans les modèles animaux[14].
Elle est sélective pour le type B de MAO par rapport au type A par un facteur de quatorze[10].
Métabolisme
[modifier | modifier le code]La rasagiline est décomposée par le CYP1A2[11], qui fait partie du métabolisme du cytochrome P450 dans le foie. Elle est contre-indiquée chez les patients souffrant d'insuffisance hépatique et son utilisation doit être surveillée attentivement chez les patients prenant d'autres médicaments qui altèrent l'efficacité normale de ce chemin métabolique[12].
Indications
[modifier | modifier le code]Toxicité, interactions, effets secondaires
[modifier | modifier le code]La notice d'avertissement de la FDA contient les avertissements selon lesquels la rasagiline peut provoquer une hypertension ou une hypotension grave, peut provoquer des somnolences, peut aggraver le contrôle moteur chez certaines personnes, peut provoquer des hallucinations et un comportement de type psychotique, peut provoquer un trouble du contrôle des impulsions, peut augmenter le risque de mélanome et, en cas de sevrage, peut provoquer une forte fièvre ou un état de confusion[12].
Les effets secondaires lorsque le médicament est pris seul comprennent des symptômes de type grippal, des douleurs articulaires, une dépression, des troubles gastriques, des maux de tête, des vertiges et de l'insomnie. Lorsqu'il est pris avec la L-DOPA, les effets secondaires comprennent une augmentation des problèmes de motricité, des blessures accidentelles, des chutes soudaines de la tension artérielle, des douleurs et des gonflements articulaires, une sécheresse de la bouche, des éruptions cutanées, des rêves anormaux et des problèmes digestifs, notamment des vomissements, une perte d'appétit, une perte de poids, des douleurs abdominales, des nausées et de la constipation[12].
Mélanome
[modifier | modifier le code]Le signalement d'une fréquence accrue de mélanomes au cours du développement clinique de la rasagiline a suscité un regain d'intérêt pour une association possible entre le cancer de la peau et la maladie de Parkinson. Un examen critique de toutes les études cliniques disponibles en 2010 (26) concernant l'association entre le cancer de la peau et la maladie de Parkinson suggèrent que le risque de cancer est réduit chez les patients atteints de la maladie de Parkinson. Cependant, des cancers spécifiques comme la thyroïde et le sein féminin ont des taux plus élevés. les données suggèrent que les patients atteints de la maladie de Parkinson ont une fréquence plus élevée de mélanomes et de cancers de la peau autres que le mélanome que la population générale. Les facteurs de causalité restent inconnus et en raison de la faible association, aucune recommandation solide ne peut être faite quant à la nécessité d'un dépistage dermatologique périodique[13].
Contre-indications
[modifier | modifier le code]Les personnes qui prennent de la mépéridine, du tramadol, de la méthadone, du propoxyphène, du dextrométhorphane, du millepertuis, de la cyclobenzaprine ou un autre inhibiteur de la MAO ne doivent pas prendre de rasagiline[12].
La notice d'avertissement de la FDA comporte un avertissement sur le risque de syndrome sérotoninergique lorsque la rasagiline est utilisée avec des antidépresseurs ou avec la mépéridine. Le risque semble toutefois faible, selon une étude rétrospective multicentrique menée sur 1504 personnes, qui s'est intéressé au syndrome sérotoninergique chez des personnes atteintes de la maladie de Parkinson traitées avec de la rasagiline associée à des antidépresseurs, de la rasagiline sans antidépresseurs ou des antidépresseurs associés à des médicaments autres que la rasagiline ou la sélégiline ; aucun cas n'ayant été identifié[4].
Il existe un risque de psychose ou de comportement bizarre si la rasagiline est utilisée avec le dextrométhorphane et il existe un risque d'inhibition non sélective de la MAO et de crise d'hypertension si la rasagiline est utilisée avec d'autres inhibiteurs de la MAO[12].
Recherche
[modifier | modifier le code]Teva a mené des essais cliniques pour tenter de prouver que la rasagiline ne traitait pas seulement les symptômes, mais qu'elle était un médicament modificateur de la maladie - qu'elle prévenait en fait la mort des neurones dopaminergiques qui caractérisent la maladie de Parkinson et ralentissait la progression de la maladie. Teva a mené deux essais cliniques, appelés TEMPO et ADAGIO, pour tenter de le prouver. Le comité consultatif de la FDA a rejeté leur demande en 2011, affirmant que les résultats des essais cliniques ne prouvaient pas que la rasagiline était neuroprotectrice. La raison principale était que dans l'un des essais, la dose la plus faible était efficace pour ralentir la progression, mais pas la dose la plus élevée, ce qui n'avait aucun sens au regard de la pharmacologie dose-réponse standard[14],[15].
Une autre étude sur 683 patients a montré une absence d'avantages à long terme d'un traitement précoce à la rasagiline sur l'évolution de la maladie[16].
Notes et références
[modifier | modifier le code]- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Andreas Kupsch, « Rasagiline. Teva Pharmaceutical », Curr Opin Investig Drugs, vol. 3, no 5, , p. 794-7. (PMID 12090555)
- Pierre Arsenault et Valérie Chiasson-Roussel, « La maladie de Parkinson-II : la place de la rasagiline (Azilect) », Le Médecin du Québec, vol. 43, no 12, , p. 87-9. (lire en ligne [PDF])
- F Stocchi et C Torti M Fossati, « Rasagiline for the treatment of Parkinson's disease: an update », Expert Opin Pharmacother, vol. 16, no 14, , p. 2231–41 (PMID 26364897, DOI 10.1517/14656566.2015.1086748, S2CID 6823552)
- G Engberg, T Elebring et H Nissbrandt, « Deprenyl (selegiline), a selective MAO-B inhibitor with active metabolites; effects on locomotor activity, dopaminergic neurotransmission and firing rate of nigral dopamine neurons », The Journal of Pharmacology and Experimental Therapeutics, vol. 259, no 2, , p. 841–7 (PMID 1658311)
- Foye's Principles of Medicinal Chemistry, Lippincott Williams & Wilkins, , 1520 p. (ISBN 978-1-60913-345-0, lire en ligne), p. 434
- Orit Bar Am, Tamar Amit et Moussa B. H. Youdim, « Contrasting neuroprotective and neurotoxic actions of respective metabolites of anti-Parkinson drugs rasagiline and selegiline », Neuroscience Letters, vol. 355, no 3, , p. 169–172 (ISSN 0304-3940, PMID 14732458, DOI 10.1016/j.neulet.2003.10.067, S2CID 20471004)
- S. Yasar, J. P. Goldberg et S. R. Goldberg, « Are metabolites of l-deprenyl (selegiline) useful or harmful? Indications from preclinical research », Journal of Neural Transmission. Supplementum, vol. 48, , p. 61–73 (ISBN 978-3-211-82891-5, ISSN 0303-6995, PMID 8988462, DOI 10.1007/978-3-7091-7494-4_6)
- Chen JJ, Swope DM, « Clinical pharmacology of rasagiline: a novel, second-generation propargylamine for the treatment of Parkinson disease », J Clin Pharmacol, vol. 45, no 8, , p. 878–94 (PMID 16027398, DOI 10.1177/0091270005277935, lire en ligne [archive du ], consulté le )
- Binda C, Hubálek F, Li M, Herzig Y, Sterling J, Edmondson DE, Mattevi A, « Binding of Rasagiline-related Inhibitors to Human Monoamine Oxidases: A Kinetic and Crystallographic Analysis », Journal of Medicinal Chemistry, vol. 48, no 26, , p. 8148–54 (PMID 16366596, PMCID 2519603, DOI 10.1021/jm0506266)
- Lecht S, Haroutiunian S, Hoffman A, Lazarovici P, « Rasagiline – a novel MAO B inhibitor in Parkinson's disease therapy », Ther Clin Risk Manag, vol. 3, no 3, , p. 467–74 (PMID 18488080, PMCID 2386362)
- Azilect Prescribing Information Label last revised May, 2014
- (en) Joaquim J. Ferreira, Dulce Neutel, Tiago Mestre et Miguel Coelho, « Skin cancer and Parkinson's disease », Movement Disorders, vol. 25, no 2, , p. 139–148 (ISSN 1531-8257, DOI 10.1002/mds.22855, lire en ligne, consulté le )
- Vadim Sviderski for Reuters and Haaretz. Oct 19, 2011 FDA Advisers Refuse Teva Plea to Expand Azilect Label
- Russel Katz, M.D., « Peripheral and Central Nervous System Advisory Committee Background Package on Azilect », FDA (consulté le )
- (en) Olivier Rascol, Robert A. Hauser, Fabrizio Stocchi et Cheryl J. Fitzer‐Attas, « Long-term effects of rasagiline and the natural history of treated Parkinson's disease », Movement Disorders, vol. 31, no 10, , p. 1489–1496 (ISSN 1531-8257, DOI 10.1002/mds.26724, lire en ligne, consulté le )
Voir aussi
[modifier | modifier le code]Article connexe
[modifier | modifier le code]Liens externes
[modifier | modifier le code]- Page spécifique dans la base de données sur les produits pharmaceutiques (Canada)
- Compendium suisse des médicaments : spécialités contenant Rasagiline
- Page spécifique sur le Répertoire Commenté des Médicaments, par le Centre belge d'information pharmacothérapeutique
- Page spécifique sur le Vidal.fr
