Orbital

Innen kjemi og partikkelfysikk er orbital betegnelsen på de områdene elektronet kan opptre i rundt et enkelt atom. Tidligere antok man at elektronene var partikler som gikk i separate baner (en. orbit) rundt atomkjernen på samme måten som planetene kretser rundt sola. Men i kvantemekanikken som beskriver materiens bølge-partikkel-dualitet kan partikler på dette nivået ikke sees som distinkt avgrensede fysiske gjenstander. I stedet beskrives de som en elektronsky med en romlig fordeling som angir sannsynligheten for partikkelens utstrekning og posisjon.
Et fritt elektron kan innta en hvilken som helst energitilstand, mens et elektron som er bundet til en atomkjerne bare kan anta diskrete, kvantifiserte energitilstander og orbitalene er et uttrykk for maksima i sannsynlighetsfordelingen for disse kvantifiserte energitilstandene.
Orbitalene har navn etter foreldede beskrivelser av linjene som opptrer ved spektroskopi: skarp, principal (hoved-), diffus, fundamental og g . Disse tilsvarer respektive bikvantetall: s=0, p=1, d=2, f=3 og g=4.
Orbitalnavn
[rediger | rediger kilde]Orbitalene får navn på formen:
der X er energinivå gitt ved hovedkvantetallet (elektronskall), og type er en liten bokstav som gir orbitalbetegnelse (underskall) og tilsvarer bikvantetallet (som beskriver fasongen til orbitalen) . y er antallet elektroner i dette orbitalet.
For eksempel har orbitalen (uttales "en-s-to") to elektroner, hovedkvantetall n = 1, og bikvantetall l = 0. Istedenfor hovedkvantetallet n = 1, 2, 3, 4, 5 ....., brukes i noen tilfeller bokstavene K, L, M, N, O ..... for elektronskallene.
Kvantemekanisk definisjon
[rediger | rediger kilde]
Innen kvantemekanikken er elektronets tilstand en løsning av Schrödinger-ligningen som gjøres tidsuavhengig fordi vi vil vite energifordeling over tid. Dette gir ’’bølgefunksjonen’’ , som beskriver energi i et tredimensjonalt rom. beskriver en sannsynlighet for å finne elektronet i et visst punkt i rommet, og sannsynlighetstettheten for funksjonen gir orbitalet.
Mellom forskjellige elektroner opptrer interferens som betyr at bølgefunksjonene kan forsterke eller nøytralisere hverandre avhengig av posisjon (x,y,z) og tid t. Dette medfører at systemer med flere elektroner, dvs. de fleste atomer, blir svært kompliserte å beregne.
| Interferens mellom to bølger |
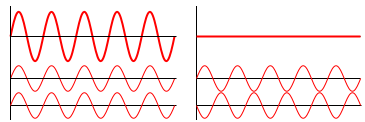
| |
| bølge 1 | ||
| bølge 2 | ||
| To bølger i fase | To bølger 180° ute av fase | |
Tillatte orbitaler
[rediger | rediger kilde]Fordi elektronene er leptoner som tilhører fermionene (partikler med 1/2 heltalls spinn), er de underlagt Paulis utelukkelsesprinsipp som sier at like partikler i samme atom ikke kan eksistere i samme tilstand. Det er derfor bare plass til et bestemt antall elektroner i hvert orbital. Løsningen av disse ligningene gir et sett mulige orbitaler og tilsvarende energinivåer innenfor følgende regler:
- Orbitalene kan i prinsippet ha et hvilket som helst hovedkvantetall n, men i praksis vil høyere orbitaler normalt ha energi som er nær ioniseringsnivået og disse elektronene vil lett kunne frigjøres fullstendig.
- Hvert orbital har suborbitaler (bikvantetallet) som er null og naturlige tall opp til (n-1).
- Hvert suborbital tillater elektronene å innta magnetisk kvantetall mi tilsvarende - ..0...+.
- Og innen hvert magnetisk kvantetall kan elektronet som fermion ha spinn +½ eller -½
Tilsammen gir dette følgende tilstander som dekker basisenerginivåene for alle kjente grunnstoffer: .[1]
| Hovedkvante tall n |
Bikvante- tall |
Orbital betegnelse |
Magnetisk kvante- tall mi |
Antall orbitaler |
Spinn kvante- tall si |
Antall elektroner |
Antall elektr. orbital/totalt |
|---|---|---|---|---|---|---|---|
| 1 (K) | 0 | 1s | 0 | 1 | ±½ | 2 | 2/2 |
| 2 (L) | 0 1 |
2s 2p |
0 -1,0,1 |
1 3 |
±½ ±½ |
2 6 |
8/10 |
| 3 (M) | 0 1 2 |
3s 3p 3d |
0 -1,0,1 -2,-1,0,1,2 |
1 3 5 |
±½ ±½ ±½ |
2 6 10 |
18/28 |
| 4 (N) | 0 1 2 3 |
4s 4p 4d 4f |
0 -1,0,1 -2,-1,0,1,2 -3,-2,-1,0,1,2,3 |
1 3 5 7 |
±½ ±½ ±½ ±½ |
2 6 10 14 |
32/60 |
| 5 (O) | 0 1 2 3 4 |
5s 5p 5d 5f 5g |
0 -1,0,1 -2,-1,0,1,2 -3,-2,-1,0,1,2,3 -4,-3,-2,-1,0,1,2,3,4 |
1 3 5 7 9 |
±½ ±½ ±½ ±½ ±½ |
2 6 10 14 18 |
50/110 |
Hydrogenlignende atomer
[rediger | rediger kilde]Spektrallinjer
[rediger | rediger kilde]For å eksitere elektronene fra et lavere til et høyere orbital må det tilføres energi i form av et foton. Et elektron vil søke laveste energinivå og vil derfor spontant gå fra et høyere orbital til en ledig plass med lavere energi, og vil da sende ut et foton. Disse fotonene vil ha en energi
- Δ
som er lik kvantespranget mellom de to orbitalene, der h er Plancks konstant (~4,135•10-15 eV•s), c er lysets hastighet, og er bølgelengden. Rydbergs formel ble eksperimentelt bestemt, og beskriver mulige kvantesprang for hydrogenlike atomer (ett elektron) som:
der m og n er orbitaler, Z er atomnummer og R er Rydbergs konstant som er eksperimentelt bestemt til ~1,097•107 m-1.
Disse ligningene og R bekreftes i dag av ikke eksperimentelle løsninger av Schrødingerligningen som gir alternative beregninger for den 'uendelige' Rydberg konstanten[2]:
-
- der
- er den reduserte Plancks konstant,
- er hvilemassen til elektronet,
- er elementærladningen,
- er lysets hastighet i vakuum, og
- er permittiviteten i tomt rom.
- der
Når forskjellige stoffer eksiteres vil de senere avgi lys med bølgelengder som er karakteristiske for hvert enkelt stoff. Disse emisjonsspektra lar en bestemme hvilke stoffer som finnes f.eks på en fjerntliggende stjerne. På samme måte vil spesifikke bølgelengder absorberes i lys som passerer gjennom en gasståke i universet eller i atmosfæren. Dette absorpsjonsspekteret viser seg som mørke linjer i lysspekteret og lar oss bestemme hvilke gasser tåken eller atmosfæren inneholder. Dette brukes også ved spektroskopi for å bestemme innholdet i en prøve.
Energinivåer
[rediger | rediger kilde]Man kunne ved hjelp av spektrallinjene bestemme orbitalenes energinivå for hydrogenlike atomer til:
som her er negativ fordi den angir bundet energi i forhold til et fritt elektron. Elektronets bindingsenergi er gitt eksklusivt av hovedkvantetallet n, og energien for forskjellige bikvantetall er lik. Laveste orbital n=1 for hydrogen (Z=1) har den laveste energitilstanden og tilsvarer -13,6 eV som er ioniseringsenergien for hydrogen. Disse energinivåene fremkommer i dag som komplekse løsninger av bølgefunksjonen og gir energinivået for hvert orbital. Det er imidlertid fortsatt små avvik mellom beregnede og eksperimentelle verdier, som dels skyldes manglende innarbeiding av relativistiske effekter og dels underliggende kvantumvariasjoner (forklares).
Atomer med flere elektroner
[rediger | rediger kilde]I atomer med flere elektroner blir løsningene langt mer komplisert. Elektronene påvirker hverandre gjensidig, og energinivåene avhenger nå også av de gjensidige romlige sannsynlighetsfordelingene av elektronene. Orbitalets energinivå avhenger både av hovedkvantetall og bikvantetall . Atomer med mer enn noen få elektroner er utenfor dagens beregningskapasitet og metoder, og må bestemmes eksperimentelt.
Høyere verdier av tilsvarer høyere energinivåer, slik at f.eks 2p generelt har høyere energinivå enn 2s. Når =3 (d) blir energiøkningen så stor at energien totalt er høyere enn s orbitalet for neste hovedkvantetall, og for =3 er f orbitalets energinivå høyere enn s orbitalet to kvantetall høyere. Orbitalenes energi varierer imidlertid med Z, f.eks på grunn av skjermingseffekter slik at rekkefølgen forandrer seg.F.eks er 3d bare høyere enn 4s for Z=20 (K) og 21 (Ca)
Energirekkefølgen vises generelt i følgende tabell for de 24 første kombinasjonene hoved- og bikvantettall (tomme celler er ikke tillatte kombinasjoner).
| 1 | 1 | ||||
|---|---|---|---|---|---|
| 2 | 2 | 3 | |||
| 3 | 4 | 5 | 7 | ||
| 4 | 6 | 8 | 10 | 13 | |
| 5 | 9 | 11 | 14 | 17 | 21 |
| 6 | 12 | 15 | 18 | 22 | 26 |
| 7 | 16 | 19 | 23 | 27 | 32 |
| 8 | 20 | 24 | 28 | 33 | 38 |
Orbitalene fylles opp fra laveste energinivå (dvs i nummerorden etter tabellen over), elektroner kan okkupere høyere nivåer dersom disse er tilgjengelig, men vil etter kort tid falle ned i et lavere ledig orbital og avgi et foton tilsvarende kvantespranget (se over). Ledig betyr i denne sammenheng at det ikke ekstisterer et annet elektron med samme kvantetall: n,,mi og si.
Orbitalenes form
[rediger | rediger kilde]
Beskrivelsen av orbitalenes form er i sin natur unøyaktig. Et hvilket som helst elektron vil til forskjellige tider kunne befinne seg i en hvilken som helst avstand og retning fra atomkjernen på grunn av uskarphetsrelasjonen
Men elektronet har mye høyere sannsynlighet for å befinne seg i enkelte områder, og man kan beskrive en grenseflate der elektronet har høy sannsynlighet for å befinne seg i det innesluttede volumet og lav sannsynlighet for å befinne seg utenfor denne grenseflaten. Den eksakte grensen kan velges tilfeldig men vil følge et nivå for sannsynlighetsfordelingen (se over). Denne grenseflaten definerer orbitalets form.
Hovedkvantetallet bestemmer overordnet orbitalets energi og størrelse, og ettersom øker, øker også orbitalets størrelse.
Generelt bestemmer bikvantetallet orbitalets form og magnetisk kvantetall orienteringen, men formen vil avhenge av forhold mellom og mi. s-orbitalet har kuleform med senter i atomkjernen. p-orbitalet har form av to ellipsoider tangerer hverandre ved kjernen og de tre p orbitalene (magnetisk kvantetall -1,0,1) er orientert med aksen gjennom senter av ellipsoidene og tangeringspunktet ligger langs x,y,og z aksen. Generelt er mi=0 symmetrisk om z-aksen og -/+mi innebærer 90 grader rotasjon om en akse. Høyere nivåer fører til stadig mer komplekse former. Orbitaler for atomer med flere elektroner vil være forskjellig fra en-atom orbitaler, men normalt antar man at orbitalene er tilnærmet lik disse.

Orbitalets form vil sammen med kjerneladningene (atomnummer) ha betydning for molekylets geometri. I vann (H2O) er ytterste orbital for oksygenet 2p4 og for hydrogen 1s1. S-orbitalet er symmetrisk, mens de to halvfylte p orbitalene står 90° på hverandre og i utgangspunktet plasserer hydrogenatomene i en vinkel på 90 grader med hverandre. Fordi oksygen har høy elektronegativitet får vi en polar kovalent binding og elektronene vil stor grad være tiltrukket oksygenet og skjerme denne kjernen. De uskjermede hydrogenkjernene gir derfor en gjensidig frastøtende kraft. Summen av disse effektene forklarer vannets bindingsvinkel på omkring 104.5°[4]
Elektroner, orbitaler og det periodiske system
[rediger | rediger kilde]Oppbyggingen av det periodiske system og grunnstoffenes kjemiske egenskaper er nært knyttet til organiseringen av orbitalene. Hovedkvantetall tilsvarer plasseringen i periode.
Det periodiske system deles også opp i blokker. Innen hver blokk har alle grunnstoffene sine ytterste elektroner i samme bikvantetall , og stoffene innen hver blokk har mange av de samme egenskapene. For eksempel har de to venstre kolonnene (Gruppe 1 og 2) sine ytterste elektroner i s-orbitalet (f.eks Li,Be i 2s og Na,Mg i 3s) og er alkalimetaller og jordalkalimetaller. Elektronene i ytterste skall kalles valenselektroner og antall elektroner i forhold til fullt subskall definerer i stor grad atomets kjemiske egenskaper og hvordan det forbinder seg med andre atomer til molekyler.
Antallet elektroner i et nøytralt atom tilsvarer atomnummeret, dvs. antall protoner i kjernen.
Se også
[rediger | rediger kilde]Referanser
[rediger | rediger kilde]- ^ P. Kofstad 1992,Uorganisk kjemi ISBN 82-518-3042-7
- ^ 2002 CODATA 2002: resultater
- ^ Shriver and Atkins 1994: Inorganic Chemistry ISBN 0-7167-2398-0
- ^ Dr. Richard F.W. Bader, An Introduction to the Electronic Structure of Atoms and Molecules, http://www.chemistry.mcmaster.ca/esam/Chapter_6/section_4.html
Eksterne lenker
[rediger | rediger kilde]- CODATA International Council for Science : Committee on Data for Science and Technology
- Guide to atomic orbitals
- Covalent Bonds and Molecular Structure Arkivert 10. februar 2009 hos Wayback Machine.
- The Orbitron, a visualization of all common and uncommon atomic orbitals, from 1s to 7g
- David Manthey's Orbital Viewer renders orbitals with n ≤ 30
- Java orbital viewer applet
























